��Ŀ����
��25��ʱ��2L���ܱ�������A��B��C��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
����д���пհף�
��1���÷�Ӧ����ʽ�ɱ�ʾΪ ����Ӧ��ƽ��ʱ��A��ת����Ϊ ��
��2���ӷ�Ӧ��ʼ���ﻯѧƽ�⣬��Ӧ��A��ƽ����Ӧ����Ϊ ��25��ʱ����Ӧ�Ļ�ѧƽ�ⳣ��KֵΪ_____________��
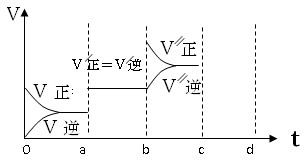
��3������֪�÷�ӦΪ���ȷ�Ӧ����ͼ��ʾ���������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������ ��b c�����иı������������ ��
��4�����������Ӧ��ʼ�ǰ���1molA+3molB�����룬��ƽ��ʱC��Ũ��Ϊa mol/L��ά������������¶Ȳ��䣬�����з����ı���ʼ���ʵ������ﵽƽ��ʱC��Ũ����Ϊa mol/L���� ������ţ���
��2 mol A+6 mol B ��2mol C ��4mol C ��0.5 mol A+1.5mol B+1 mol C
| �� �� | A | B | C |
| ��ʼŨ��/mol��L-1 | 1.0 | 2.0 | 0 |
| 2minʱ��ƽ��Ũ��/mol��L-1 | 0.4 | 0.2 | 1.2 |
��1���÷�Ӧ����ʽ�ɱ�ʾΪ ����Ӧ��ƽ��ʱ��A��ת����Ϊ ��
��2���ӷ�Ӧ��ʼ���ﻯѧƽ�⣬��Ӧ��A��ƽ����Ӧ����Ϊ ��25��ʱ����Ӧ�Ļ�ѧƽ�ⳣ��KֵΪ_____________��
��3������֪�÷�ӦΪ���ȷ�Ӧ����ͼ��ʾ���������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������ ��b c�����иı������������ ��

��4�����������Ӧ��ʼ�ǰ���1molA+3molB�����룬��ƽ��ʱC��Ũ��Ϊa mol/L��ά������������¶Ȳ��䣬�����з����ı���ʼ���ʵ������ﵽƽ��ʱC��Ũ����Ϊa mol/L���� ������ţ���
��2 mol A+6 mol B ��2mol C ��4mol C ��0.5 mol A+1.5mol B+1 mol C
��ÿ��2�֣���14�֣�
��1��A(g) + 3B(g) 2C(g) ��2�֣� 60����2�֣�
2C(g) ��2�֣� 60����2�֣�
��2��0.3 mol/(L�qmin) ��2�֣� 4.5��102 ��450��L2��mol-2��2�֣�
��3�����������2�֣� ����A��B����Ӧ���Ũ�ȣ�2�֣�[˵��������ѹǿ�������¶�v(��) ��v(��)����˲������v��(��)������ƽ��ʱv��(��)������]
��4���ڢ� ��2�֣�ѡ1������ȷ1�֣���1��0�֣�
��1��A(g) + 3B(g)
 2C(g) ��2�֣� 60����2�֣�
2C(g) ��2�֣� 60����2�֣���2��0.3 mol/(L�qmin) ��2�֣� 4.5��102 ��450��L2��mol-2��2�֣�
��3�����������2�֣� ����A��B����Ӧ���Ũ�ȣ�2�֣�[˵��������ѹǿ�������¶�v(��) ��v(��)����˲������v��(��)������ƽ��ʱv��(��)������]
��4���ڢ� ��2�֣�ѡ1������ȷ1�֣���1��0�֣�
��1�����ݱ������ݿ�֪��2min��A��Ũ�ȼ���0.6mol/L��B��Ũ�ȼ���1.8mol/L����C��Ũ������1.2mol/L�����Ը������ʵı仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪���÷�Ӧ�ķ���ʽ��A(g) + 3B(g) 2C(g)����Ӧ��ƽ��ʱ��A��ת����Ϊ0.6��1.0��0.6����60����
2C(g)����Ӧ��ƽ��ʱ��A��ת����Ϊ0.6��1.0��0.6����60����
��2��2min������A��Ũ�ȱ仯��0.6mol/L�����Է�Ӧ��A��ƽ����Ӧ����Ϊ0.6mol/L��2min��0.3 mol/(L�qmin)����ѧ��������һ�������µĿ��淴Ӧ�У������淴Ӧ��Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�Ӧ�ķ���ʽ��֪���÷�Ӧ��ƽ�ⳣ����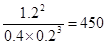 ��
��
��3������ͼ���֪��a b���������淴Ӧ���ʶ�������ģ���ƽ�ⲻ�ƶ������ڷ�Ӧ�������С�Ŀ��淴Ӧ�����Ըı������ֻ����ʹ���˴�����b c�������淴Ӧ��������������Ӧ����ͻȻ����Ȼ�����ٽ��ͣ�ƽ��������Ӧ�����ƶ������Ըı������������A��B����Ӧ�Ũ�ȡ�
��4�����ڷ�Ӧ�����������ݻ����¶��Dz���ģ���Ҫʹƽ���Ч������ݻ�ѧ����ʽ����֮�������A��B�����ʵ�������ֱ����1mol��3mol��2molC���൱����1molA��3molB������ѡ�����Ҳ�൱����1molA��3molB����ѡ��ٺ͢��ǵ�Ч�ģ������ȷ�Ĵ�ѡ�ڢܡ�
 2C(g)����Ӧ��ƽ��ʱ��A��ת����Ϊ0.6��1.0��0.6����60����
2C(g)����Ӧ��ƽ��ʱ��A��ת����Ϊ0.6��1.0��0.6����60������2��2min������A��Ũ�ȱ仯��0.6mol/L�����Է�Ӧ��A��ƽ����Ӧ����Ϊ0.6mol/L��2min��0.3 mol/(L�qmin)����ѧ��������һ�������µĿ��淴Ӧ�У������淴Ӧ��Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�Ӧ�ķ���ʽ��֪���÷�Ӧ��ƽ�ⳣ����
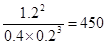 ��
����3������ͼ���֪��a b���������淴Ӧ���ʶ�������ģ���ƽ�ⲻ�ƶ������ڷ�Ӧ�������С�Ŀ��淴Ӧ�����Ըı������ֻ����ʹ���˴�����b c�������淴Ӧ��������������Ӧ����ͻȻ����Ȼ�����ٽ��ͣ�ƽ��������Ӧ�����ƶ������Ըı������������A��B����Ӧ�Ũ�ȡ�
��4�����ڷ�Ӧ�����������ݻ����¶��Dz���ģ���Ҫʹƽ���Ч������ݻ�ѧ����ʽ����֮�������A��B�����ʵ�������ֱ����1mol��3mol��2molC���൱����1molA��3molB������ѡ�����Ҳ�൱����1molA��3molB����ѡ��ٺ͢��ǵ�Ч�ģ������ȷ�Ĵ�ѡ�ڢܡ�

��ϰ��ϵ�д�
�����Ŀ
 zC
zC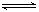 2C(g) ��H��0�����и�ͼ��ȷ����
2C(g) ��H��0�����и�ͼ��ȷ����
 xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף� mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol
mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol 2C(g) �ﵽƽ��ı�־��
2C(g) �ﵽƽ��ı�־�� CO2��g����NO��g����H <0�ķ�Ӧ���ﵽƽ������¶ȣ�����������ɫ
CO2��g����NO��g����H <0�ķ�Ӧ���ﵽƽ������¶ȣ�����������ɫ CH3OH��g����H
CH3OH��g����H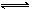 xC����)��yD����)�ﵽƽ��ʱ��C���������Ϊm%����ά���¶�ѹǿ���䣬��0.6LA��0.4LB��4LC��0.8LD��Ϊ��ʼ���ʳ����ܱ������У��ﵽƽ��ʱC�����������Ϊm%����x��y��ֵ�ֱ�Ϊ
xC����)��yD����)�ﵽƽ��ʱ��C���������Ϊm%����ά���¶�ѹǿ���䣬��0.6LA��0.4LB��4LC��0.8LD��Ϊ��ʼ���ʳ����ܱ������У��ﵽƽ��ʱC�����������Ϊm%����x��y��ֵ�ֱ�Ϊ