题目内容
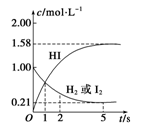
(10分).698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)  2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=__________。
(2)该反应达到最大限度的时间是________,该时间内平均反应速率v(HI)=________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=__________。
(2)该反应达到最大限度的时间是________,该时间内平均反应速率v(HI)=________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
(1)2 L (2)5 s 0.316 mol·L-1·s-1 (3)放出 41.87 kJ
(1)根据图像可知,氢气的起始浓度是1.00molL,起始物质的量是2mol,所以容器容积是2L。
(2)根据图像可知,当反应进行到5s时,各种物质的浓度不再发生变化,说明反应达到平衡状态;5s内HI的浓度改变了1.58mol/L,所以HI的反应速率是1.58mol/L÷5s=0.316 mol·L-1·s-1。
(3)根据图像可知,氢气的浓度减少了0.79mol/L,所以消耗氢气的物质的量是0.79mol/L×2L=1.58mol,因此反应放出的热量是1.58mol×26.5 kJ·mol-1=41.87 kJ。
(2)根据图像可知,当反应进行到5s时,各种物质的浓度不再发生变化,说明反应达到平衡状态;5s内HI的浓度改变了1.58mol/L,所以HI的反应速率是1.58mol/L÷5s=0.316 mol·L-1·s-1。
(3)根据图像可知,氢气的浓度减少了0.79mol/L,所以消耗氢气的物质的量是0.79mol/L×2L=1.58mol,因此反应放出的热量是1.58mol×26.5 kJ·mol-1=41.87 kJ。

练习册系列答案
相关题目
 CH3OH(g)△H
CH3OH(g)△H PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是( )
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是( ) 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是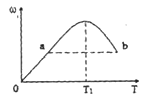
 Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Cu(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下: xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为  p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是
p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是 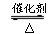 2SO3 。对该反应的有关说法错误的是
2SO3 。对该反应的有关说法错误的是