题目内容
(8分)t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)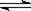 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______________________。
(2)达到平衡状态时,B 物质的转化率α(B) = _____________,
平衡常数K= _____________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡__________(填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
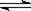 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______________________。
(2)达到平衡状态时,B 物质的转化率α(B) = _____________,
平衡常数K= _____________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡__________(填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
(8分)(1)0.2mol/(L·min-1),(2)20% , 1/27=0.037 (3)C
试题分析:(1)平衡时C的浓度是0.4 mol/L,所以C的反应速率是0.4mol/L÷2min=0.2mol/(L·min-1)。
(2)根据反应的化学方程式可知,消耗B的浓度是0.4mol/L÷4=0.1mol/L,所以B的转化率是0.1÷0.5=20%。平衡时A和B的浓度分别是1.mol/L-0.3mol/L和0.5mol/L-0.1mol/L=0.4mol/L,所以该反应的平衡常数K=
 。
。(3)若继续向原混和物质通入少量氦气,压强增大,但反应物和生成物的浓度没有变化,所以平衡不移动,答案选C。
点评:在判断压强对平衡状态的影响时,不能中看压强的变化,关键是是看物质的浓度是否发生了变化。因为浓度对反应速率或平衡状态的影响,是提高改变浓度引起的。如果只是压强升高,而浓度不变,则反应速率和平衡状态是不变的,例如该题的最后一问。

练习册系列答案
相关题目
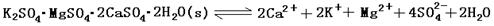
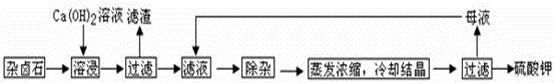
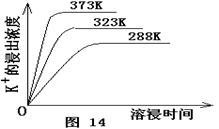

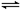 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
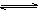 C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( ) PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。
PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。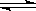 zC
zC Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是( )