题目内容
设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A、常温下,1L 0.1mol/L的NH4NO3溶液中氧原子数为0.3NA |
| B、1mol的羟基与1mol的氢氧根离子所含电子数均为10NA |
| C、常温、常压下,4.6g NO2和N2O4混合气体中含有的O原子数目为0.2NA |
| D、Fe与水蒸气在高温条件下反应,有1mol Fe参与反应,则转移电子的数目为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.硝酸铵溶液中,溶剂水中含有氧原子,无法计算溶液中含有的氧原子数目;
B.羟基中含有9个电子,氢氧根离子中含有10个电子;
C.NO2和N2O4的最简式为NO2,根据二者的最简式计算出混合物中含有的氧原子数目;
D.铁与水蒸气反应生成的是四氧化三铁,1mol铁完全反应失去
mol电子.
B.羟基中含有9个电子,氢氧根离子中含有10个电子;
C.NO2和N2O4的最简式为NO2,根据二者的最简式计算出混合物中含有的氧原子数目;
D.铁与水蒸气反应生成的是四氧化三铁,1mol铁完全反应失去
| 8 |
| 3 |
解答:
解:A.1L 0.1mol/L的NH4NO3溶液中含有硝酸铵0.1mol,0.1mol硝酸铵中含有0.3mol氧原子,由于水中含有氧原子,所以该硝酸铵溶液中含有的氧原子大于0.3mol,溶液中氧原子数大于0.3NA,故A错误;
B.1mol羟基中含有9mol电子,1mol氢氧根离子中含有10mol电子,二者含有的电子数不同,故B错误;
C.4.6g NO2和N2O4混合气体中含有0.1mol最简式NO2,含有氧原子的物质的量为0.2mol,混合气体中含有的O原子数目为0.2NA,故C正确;
D.1mol铁与水蒸气在高温下反应生成四氧化三铁,失去了
mol电子,根据电子守恒,转移电子的数目为
NA,故D错误;
故选C.
B.1mol羟基中含有9mol电子,1mol氢氧根离子中含有10mol电子,二者含有的电子数不同,故B错误;
C.4.6g NO2和N2O4混合气体中含有0.1mol最简式NO2,含有氧原子的物质的量为0.2mol,混合气体中含有的O原子数目为0.2NA,故C正确;
D.1mol铁与水蒸气在高温下反应生成四氧化三铁,失去了
| 8 |
| 3 |
| 8 |
| 3 |
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意明确羟基与氢氧根离子的区别、铁与水蒸气的反应生成的是四氧化三铁.

练习册系列答案
相关题目
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式正确的是( )
| A、5H218O2+2KMnO4+3H2SO4═518O2↑+K2SO4+2MnSO4+8H2O |
| B、CH3COOH+C2H518OH→CH3COOCH2CH3+H218O |
| C、2Na2O2+2H218O═4NaOH+18O2↑ |
| D、K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
常温下,将乙酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
根据电子排布的特点,Cu在周期表属于( )
| A、s区 | B、p区 | C、d区 | D、ds区 |
下列有关化学用语表述正确的是( )
A、CO2的电子式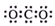 | ||
B、Cl-的结构示意图 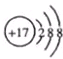 | ||
| C、次氯酸的结构式 H-Cl-O | ||
D、质量数为37的氯原子
|
化学与环境、材料、能源关系密切,下列说法错误的是( )
| A、水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 |
| B、煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
CO2通入下列各溶液中,不能产生沉淀的是( )
| A、CaCl2溶液 |
| B、Na2SiO3溶液 |
| C、Ca(OH)2溶液 |
| D、Ba(OH)2溶液 |
下列气体中,既可用浓硫酸干燥,又可以用碱石灰干燥的是( )
| A、NO2 |
| B、SO2 |
| C、NH3 |
| D、O2 |