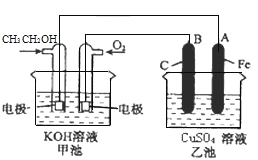
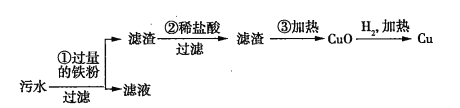
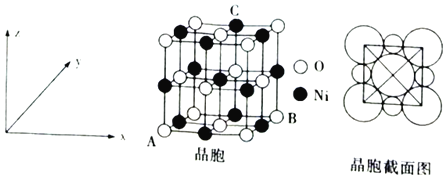
题目内容
【题目】常温下,用0.100mol/L的NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和0.100mol/L的醋酸,得到两条滴定曲线,如图所示:
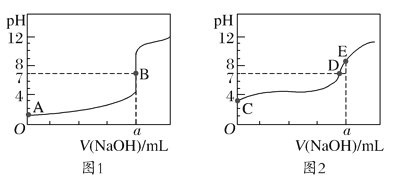
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞作指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0mL<V(NaOH)<20.00mL时,图2对应混合液中各离子浓度由大到小的顺序一定是c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】C
【解析】
A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH:醋酸![]() 盐酸,根据图象知,图1是滴定盐酸、图2是滴定醋酸,A错误;
盐酸,根据图象知,图1是滴定盐酸、图2是滴定醋酸,A错误;
B.甲基橙的变色范围是3.1~4.4、酚酞的变色范围是8.2~10.0,由图2中pH突变的范围(pH>7)可知,当氢氧化钠溶液滴定醋酸时,只能选择酚酞作指示剂,B错误;
C.B、E两点对应消耗氢氧化钠溶液的体积均为a mL,所以反应消耗的n(CH3COOH)=n(HCl),C正确;
D.当0mL<V(NaOH)<20.00mL时,图2对应的是NaOH滴定CH3COOH,混合溶液可能显中性,此时c(A-)=c(Na+)>c(H+)=c(OH-),D错误;
故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】中和热的测定是重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从图中实验装置看,其中尚缺少的两种玻璃用品是_____________,为保证该实验成功,该同学采取了许多措施,如图的泡沫塑料块的作用在于________________
(2)倒入NaOH溶液的正确操作是:_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验记录数据如表
项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
HCl | NaOH | 平均温度 | |||
第1次 | 26.2 | 26.0 | 29.4 | ||
第2次 | 27.0 | 27.4 | 32.2 | ||
第3次 | 25.9 | 25.9 | 29.1 | ||
第4次 | 26.4 | 26.2 | 29.7 | ||
设0.55mol/LNaOH溶液和0
(4)不能用醋酸代替盐酸做此实验,原因是____________________。
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:___。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | A的分子式为:___。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况)。 | 写出A中含有的官能团___、__。 |
(4)A的核磁共振氢谱如图: | 综上所述,A的结构简式为___。 |
【题目】(1)氨是最重要的氮肥,是产量最大的化工产品之一。在1L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示 (已知:T1<T2)
温度 | 平衡时NH3的物质的量/mol |
T1 | 3.6 |
T2 | 2 |
①则K1_______K2 (填“>”、“<”或“=”),原因:__________。
②在T2下,经过10s达到化学平衡状态,则平衡时H2的转化率为______________。若再同时增加各物质的量为1mol,则该反应的速率v正_____v逆(>或=或<),平衡常数将______(填“增大”、“减小”或“不变)。
(2)一定温度下,将3mol A气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
①反应1min时测得剩余1.8mol A,C的浓度为0.4 mol/L,则1min内B的反应速率为______,x为_______。
②若混合气体起始压强为P0,10min后达平衡,容器内混合气体总压强为P,用P0、P来表示达平衡时反应物A的转化率a(A)为__________。
③能够说明该反应达到平衡的标志是___________。
A 容器内混合气体的密度保持不变
B v(A)=3v(B)
C A、B的浓度之比为3:1
D 单位时间内消耗3 n molA的同时生成n mol B
E 体系的温度不再变化