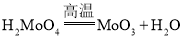题目内容
【题目】下列的叙述中,正确的是( )
A.检验溴乙烷中的溴元素,加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
B.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O→2C6H5OH +![]()
C.苯酚能与FeCl3溶液反应生成紫色沉淀
D.苯酚有强腐蚀性,沾在皮肤上可用酒精清洗
【答案】D
【解析】
有机物中溴元素以原子形式存在,不与银离子反应,故常用氢氧化钠水解后,用硝酸酸化的硝酸银发生沉淀进行检验;利用强酸制弱酸的原理,二氧化碳溶于水生成碳酸制苯酚;酚羟基与氯化铁有显色反应;苯酚能溶于酒精,据此回答问题。
A. 检验溴乙烷中的溴元素,加入NaOH溶液共热,因银离子在碱性环境下产生氢氧化银沉淀,故冷却后加入硝酸酸化的AgNO3溶液,观察有无浅黄色沉淀硫化银生成,A错误;
B. 苯酚钠溶液中通入少量二氧化碳:C6H5O-+ CO2 + H2O→C6H5OH +![]() ,B错误;
,B错误;
C. 苯酚能与FeCl3溶液反应生成紫色溶液,C错误;
D. 苯酚有强腐蚀性,利用相似相容原理,沾在皮肤上可用酒精清洗,D正确;
答案为D。

【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
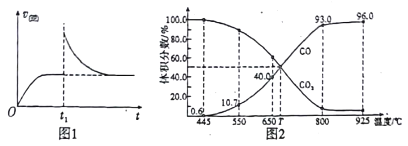
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
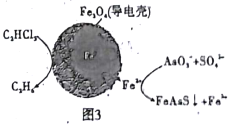
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
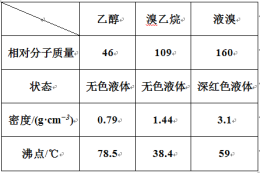
【题目】工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
![]()
则碳与水蒸气反应![]() 的
的![]() ________。
________。
![]() 工业上也可以仅利用碳和水蒸气反应得到的
工业上也可以仅利用碳和水蒸气反应得到的![]() 和
和![]() 进一步合成甲醇,反应方程式为:
进一步合成甲醇,反应方程式为:![]()
![]()
![]() 工业上此生产过程中
工业上此生产过程中![]() 和
和![]() 的转化率________
的转化率________![]() 填“前者大”、“后者大”、“一样大”或“无法判断”
填“前者大”、“后者大”、“一样大”或“无法判断”![]() ;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
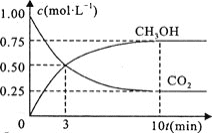
![]() 在一恒温恒容密闭容器中充入
在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得
进行上述反应。测得![]() 和
和![]() 浓度随时间变化如图所示。该温度下的平衡常数为________
浓度随时间变化如图所示。该温度下的平衡常数为________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
![]() 改变温度,使反应
改变温度,使反应![]() 中的所有物质都为气态。起始温度体积相同
中的所有物质都为气态。起始温度体积相同![]() 、
、![]() 密闭容器
密闭容器![]() ,反应过程中部分数据见下表:
,反应过程中部分数据见下表:
反应时间 |
|
|
|
| |
反应Ⅰ 恒温恒容 |
| 2 | 6 | 0 | 0 |
|
| ||||
| 1 | ||||
| 1 | ||||
反应Ⅱ 绝热恒容 |
| 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、反应Ⅱ对比:平衡常数![]() Ⅰ
Ⅰ![]() ________
________![]() Ⅱ
Ⅱ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;平衡时
;平衡时![]() 的浓度
的浓度![]() ________
________![]() Ⅱ
Ⅱ![]() 。
。
![]() 对反应
对反应![]() ,前
,前![]() 内的平均反应速率
内的平均反应速率![]() ________,若
________,若![]() 时只向容器中再充入
时只向容器中再充入![]() 和
和![]() ,则平衡________移动
,则平衡________移动![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 。
。