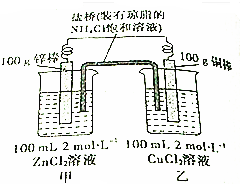
题目内容
6.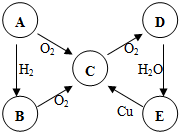 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)(1)则B是H2SE是H2SO4.E→C的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑
(2)如果A是无色气体,写出A的电子式
 B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)如果A是淡黄色固体,A与氧气反应生成C,则A为S,C为SO2,根据题中转化关系,A与氢气反应生成B为H2S,C与氧气反应生成D为SO3,D与水反应生成E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,符合转化关系;
(2)如果A是无色气体,根据题中转化关系,A能与氢气也能和氧反应,则A应为N2,B为NH3,C为NO,D为NO2,E为HNO3,铜与稀硝酸反应生成一氧化氮,符合转化关系,据此答题.
解答 解:(1)如果A是淡黄色固体,A与氧气反应生成C,则A为S,C为SO2,根据题中转化关系,A与氢气反应生成B为H2S,C与氧气反应生成D为SO3,D与水反应生成E为H2SO4,浓硫酸与铜加热条件下反应生成二氧化硫,E→C的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:H2S;H2SO4;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)如果A是无色气体,根据题中转化关系,A能与氢气也能和氧反应,则A应为N2,B为NH3,C为NO,D为NO2,E为HNO3,铜与稀硝酸反应生成一氧化氮,符合转化关系,所以A的电子式为: ,B→C的化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6 H2O,
,B→C的化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6 H2O,
故答案为: ;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6 H2O.
;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6 H2O.
点评 本题考查框图推断,题目难度中等,主要考查硫、氮的单质及其化合物知识,解题的关键是在审题的基础上找准解题的突破口,经过分析,归纳,推理,得出正确的答案.

| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
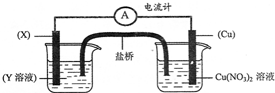
| A. | 一定增重64g | B. | 一定减重64g | ||
| C. | 可能增重64g,也可能减重64g | D. | 既不增重也不减重 |
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: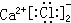 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
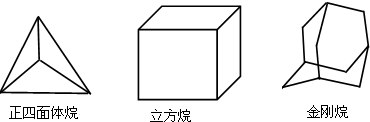 科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )
科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )| A. | 2种4种 8种 | B. | 2种4种6种 | C. | 1种3种6种 | D. | 1种3种 8种 |
| A. | 防止电池中汞、镉和铅等重金属离子污染土壤和水源 | |
| B. | 回收利用石墨电极和金属材料 | |
| C. | 充电后可再使用 | |
| D. | 防止电池中的电解质溶液腐蚀其他物品 |