题目内容
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
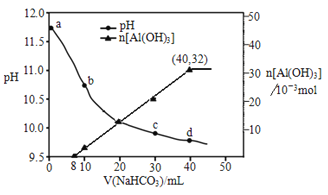
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
【答案】D
【解析】
氧化铝和氢氧化钠反应,而氧化铁不反应,过滤后得到滤液用碳酸氢钠处理,发生HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,加入40毫升碳酸氢钠溶液时沉淀最多,a、b、c点都为碱性,随着碳酸氢钠的加入,碱性减弱,以此解答。
A.偏铝酸根离子促进碳酸氢根电离,生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,故正确;B. b 点与c点溶液所含微粒种类相同,均为钠离子、偏铝酸根离子、氢氧根离子、碳酸根离子,故正确;C. a 点溶液显碱性,溶质为氢氧化钠和偏铝酸钠,存在的离子是Na+、AlO2-、OH-,故正确;D. 加入40毫升碳酸氢钠的溶液时沉淀最多,沉淀为0.032mol,氢氧化钠过量,滤液中含有氢氧化钠,由于氢氧根离子和碳酸氢根离子反应生成碳酸根离子和水,HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-可知,前8毫升不生成沉淀,NaHCO3溶液的物质的量浓度为0.032/0.032=1.0mol/L,故错误。故选D。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目