题目内容
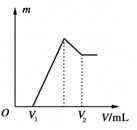
【题目】某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份。向其中一份中逐渐加入铜粉, 最多能溶解 l9.2g(已知硝酸只被还原为 NO 气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法不正确的是( )

A. c 点时,溶液中的溶质为 FeSO4
B. oa 段发生反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
C. 原混和酸中稀硝酸的物质的量浓度为 2mol/L
D. 原混和酸中稀硫酸的物质的量浓度为 4mol/L
【答案】B
【解析】
由图象可知,由于铁过量,硝酸和硫酸氧化性不同,反应分阶段进行,氧化性强的物质先反应,则oa段铁与稀硫酸和稀硝酸的混合溶液反应生成硫酸铁、一氧化氮和水,发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,ab段硫酸铁与铁反应生成硫酸亚铁,发生反应为:Fe+2Fe3+=3Fe2+,bc段铁与稀硫酸反应生成硫酸亚铁和氢气,发生反应为:Fe+2H+=Fe2++H2↑。
A项、由图象可知,混合溶液中硝酸全部被还原生成一氧化氮,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故A正确;
B项、oa段铁与稀硫酸和稀硝酸的混合溶液反应生成硫酸铁、一氧化氮和水,反应的化学方程式为:2Fe+3H2SO4+2HNO3=Fe2(SO4)3+2NO↑+4H2O,故B错误;
C项、有图像可知,oa段反应的铁的物质的量n(Fe)为0.2mol,由方程式Fe+NO3-+4H+=Fe3++NO↑+2H2O可知,n(Fe)= n(NO3-)=0.2mol,则100ml溶液中稀硝酸的物质的量浓度为 2mol/L,故C正确;
D项、c点加入22.4g铁,铁与稀硫酸和稀硝酸恰好完全反应生成硫酸亚铁,溶液中亚铁离子的物质的量为0.4mol,由电荷守恒可知,硫酸根的物质的量为0.4mol,则100ml溶液中稀硫酸的物质的量浓度为4mol/L,故D正确。
故选B。