题目内容
【题目】铁及其化合物之间的相互转化可用下式表示:
![]()
回答下列有关问题:
(1)Fe2O3中铁元素化合价为___________,实现④的转化需加入___________(填“氧化剂”或“还原剂”)。
(2)配平下面的缺项方程式
_____FeCl3 +_____ Cl2+___□![]() _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O
(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
Cl2+2Fe2+=2Cl-+2Fe3+
由上述反应可知氧化性:Co2O3_______(填“>”或“<”) Fe3+,
下列离子反应错误的是_______。
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42-+2Cl-+2H+=Cl2↑+SO32-+H2O
c. Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
(4)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
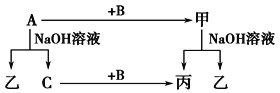
根据图示转化关系回答:
写出A与NaOH溶液反应的离子方程式________________________________。
写出A+Fe3O4→甲的化学方程式________________________________。
【答案】+3 还原剂 2、3、16NaOH、2、12、8 > b 2Al+2OH―+2H2O=2AlO2―+3H2 ↑ 8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】
(1)Fe2O3中铁元素化合价为+3价;Fe3+转化为Fe2+需加入还原剂;
(2)利用得失电子守恒配平该氧化还原反应;
(3)利用氧化剂氧化性大于氧化产物进行比较,根据“强制弱”规律判断反应能否进行;
(4)A是金属,能与NaOH溶液反应,则A是Al,乙为NaAlO2,B为O2,C为H2,丙为水,甲为氧化铝;
(1)Fe2O3中铁元素化合价为+3价;④将Fe3+转化为Fe2+,化合价降低,实现④的转化需加入还原剂;
(2)由元素守恒可知,方程式左边缺少钠元素和氢元素,所以在方程式左边补入NaOH,铁元素由+3价升高为+6价,氯元素由0价降为-1价,利用得失电子守恒进行配平可得,2FeCl3+3Cl2+16NaOH=2Na2FeO4+12NaCl+8H2O;
(3)由Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O可知,氧化性Co2O3>Cl2,由Cl2+2Fe2+=2Cl-+2Fe3+可知,氧化性Cl2>Fe3+,故氧化性Co2O3> Fe3+;由2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,可知,氧化性Fe3+> SO42-。结合之前分析可得氧化性:Co2O3>Cl2>Fe3+>SO42-,故离子反应a、c可以发生,由于氧化性Cl2>SO42-,b不可以发生;
(4)A是金属,能与NaOH溶液反应,则A是Al,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;结合图中分析可得,乙为NaAlO2,B为O2,C为H2,丙为水,甲为氧化铝,A+Fe3O4→甲的化学方程式为:8Al+3Fe3O4![]() 4Al2O3+9Fe。
4Al2O3+9Fe。