题目内容
【题目】我国科学家在某杂志上发表研究报告称,利用铬同位素的系统分析发现,“古代大气氧含量高于现代水平的1%”。铬的同位素有![]() 、
、![]() 、
、![]() 、
、![]() 。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态![]() 的价层电子排布图为_________
的价层电子排布图为_________
(2)交警用“酒精仪”查酒驾,其化学反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),其主要原因是___________。
②CH3COOH分子中碳原子的杂化类型是______;CH3COOH分子中σ键和π键数目之比为_________。
③K2SO4晶体中阴离子的空间构型是________。上述反应中,只含极性键的极性分子有________(填分子式)。
(3)晶体铬的晶胞结构如图1所示,其堆积模型为___________;铬原子的配位数为___________。

(4)铬的一种氧化物晶胞结构如图2所示。六棱柱边长为a nm,高为b nm,NA代表阿伏加德罗常数的值。该晶体的化学式为______;该晶体的密度ρ=_______g·cm-3。
【答案】![]() CH3CH2OH、CH3COOH分子间存在氢键 sp2、sp3 7:1 正四面体形 H2O、H2SO4 体心立方堆积 8 Cr2O3
CH3CH2OH、CH3COOH分子间存在氢键 sp2、sp3 7:1 正四面体形 H2O、H2SO4 体心立方堆积 8 Cr2O3 ![]()
【解析】
(1)Cr为24号元素,其核外电子排布为1s22s22p63s23p63d54s1,价电子为3d54s1,根据洪特规则,电子分别占据不同的轨道,所以价层电子排布图为![]() ;
;
(2)①在乙醇和乙酸中均有O—H键,类似于水一样,分子间可以形成氢键,使物质的熔沸点升高。
②乙酸的结构式为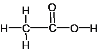 。C原子杂化类型可以从其周边的原子数判断,甲基上的C原子形成4个σ键,C上没有孤电子对,C原子的杂化类型为sp3;羧基中C形成3个σ键和1个π键,C上没有孤电子对,C原子的杂化类型为sp2。单键均为σ键,而且碳氧双键中有1个σ键和1个π键,一共有7个σ键和1个π键,则σ键和π键的比例为7:1;
。C原子杂化类型可以从其周边的原子数判断,甲基上的C原子形成4个σ键,C上没有孤电子对,C原子的杂化类型为sp3;羧基中C形成3个σ键和1个π键,C上没有孤电子对,C原子的杂化类型为sp2。单键均为σ键,而且碳氧双键中有1个σ键和1个π键,一共有7个σ键和1个π键,则σ键和π键的比例为7:1;
③SO42-的中心原子S上孤电子对数为![]() ×(6+2-4×2)=0,价层电子对数为0+4=4,S为sp3杂化,SO42-的空间构型为正四面体构型。化学方程式中2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O,属于分子的有CH3CH2OH、H2SO4、CH3COOH、H2O。CH3CH2OH、CH3COOH中都有C—C非极性键,只有极性共价键的是H2SO4、H2O,而且H2SO4、H2O都属于极性分子;
×(6+2-4×2)=0,价层电子对数为0+4=4,S为sp3杂化,SO42-的空间构型为正四面体构型。化学方程式中2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O,属于分子的有CH3CH2OH、H2SO4、CH3COOH、H2O。CH3CH2OH、CH3COOH中都有C—C非极性键,只有极性共价键的是H2SO4、H2O,而且H2SO4、H2O都属于极性分子;
(3) 晶体铬中,Cr占据了顶点和体心,所以为体心立方堆积。离中间的Cr原子最近的有8个Cr,所以其配位数为8;
(4)以整个六棱柱为整体,有4个Cr在其中,完全属于此晶胞。有3个O原子在晶胞内,完全属于此晶胞,还有2个O在面上,为2个面共用,因此有![]() 个O原子,在顶点有12个O原子,每个O原子为6个晶胞共有,因此有
个O原子,在顶点有12个O原子,每个O原子为6个晶胞共有,因此有![]() 个O原子,共3+1+2=6个O原子,Cr和O的比例为2:3,则化学式为Cr2O3。
个O原子,共3+1+2=6个O原子,Cr和O的比例为2:3,则化学式为Cr2O3。![]() ,晶胞中有4个Cr和6个O,则晶胞的质量
,晶胞中有4个Cr和6个O,则晶胞的质量![]() 。晶胞的体积
。晶胞的体积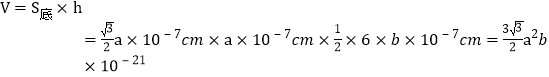 cm3,带入,得
cm3,带入,得![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】铬元素有许多独特性质,如铬作为炼钢的添加料,可生产多种高强度、抗腐 蚀、耐磨、耐高温、耐氧化的特种钢;铬的化合物色彩众多,如 Cr3+(紫色)、Cr(OH)3(灰蓝色)、 CrO2(绿色)等。请回答下列问题:
Ⅰ.铬可形成 Cr(NO3)3、NaCrO2 等盐类物质,则 NaCrO2 中铬元素的化合价为_____,向Cr(NO3)3 溶液中滴加 NaOH 溶液至过量,可观察到的主要现象是_____。
Ⅱ.铬元素的+6 价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有 Na2SO4 及少量Cr 2O72、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:金属离子生成氢氧化物沉淀的 pH 如下表所示:
氢氧化物 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的 pH | 1.5 | 6 |
沉淀完全的 pH | 3.6 | 8 |
(1)滤渣 A 的主要成分为_____。
(2)根据下图信息,可知操作 B 包含蒸发结晶和_____。

(3)酸化后的 Cr2O72-可被 SO32-还原,该反应中若有 0.5 molCr2O72-被还原为 Cr3+ ,则消耗 SO32-的物质的量为_____mol。
(4)调 pH 沉铬步骤中,应调节 pH 的范围是_____(填字母)。
A.1.5~3.6 B.3.6~6 C.6~8 D.8~9
(5)通过两步反应可以实现Cr(OH)3转化为 Cr,第一步反应为2Cr(OH)3=Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该步反应的化学方程式为_____。
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是_____________________________。
(2)④、⑥、⑧的原子半径由小到大的顺序为___________(用元素符号作答)。
(3)②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是______________(用化学式作答)。
(4)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀溶液易被催化分解,请写出M的电子式_____________,M的结构式_____________。
(5)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式_____________、_____________。
(6)⑥的金属性强于⑦,下列表述中能证明这一事实的是_____________。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(7)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,_____________沸点高(填化学式),理由是_______________________________________。


