题目内容
下图中的几种仪器装置都可以制得氢气,其中:
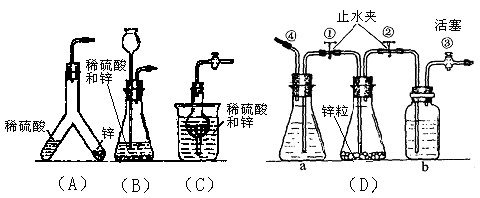
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。

(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。
(1)(C),(D);(A),(D)
(2)稀盐酸或稀硫酸;水或氢氧化钠溶液;除去H2中可能混入的酸滴或酸雾
(3)打开①②③,由④通入少量气体使稀酸流入盛锌容器内,再立即关闭①
(2)稀盐酸或稀硫酸;水或氢氧化钠溶液;除去H2中可能混入的酸滴或酸雾
(3)打开①②③,由④通入少量气体使稀酸流入盛锌容器内,再立即关闭①
试题分析:(1)能使发生或停止发生氢气操作均比较方便,这说明应该满足锌粒和稀硫酸容易脱离接触。根据装置的结构可知,A和B无法实现。C、D均是类似于启普发生器原理,可以实现,答案选CD。又因为AD选项装置内的气体压强可以很大,所以可以把氢气球充满,BC装置内的压强不能很大,如果大了,反应物会从其他地方出去,所以答案选AD。
(2)D装置中③是出气口,所以a中应该盛放稀硫酸或盐酸,而b中应该放水或氢氧化钠溶液,以除去H2中可能混入的酸滴或酸雾。
(3)要使a中的酸液进入锥形瓶中和锌反应,酸液需要通过外力是酸液被压入到锥形瓶中,所以正确的操作顺序是打开①②③,由④通入少量气体使稀酸流入盛锌容器内,再立即关闭①。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和实验方法指导与训练,有利于培养学生规范、严谨的实验设计、评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

练习册系列答案
相关题目
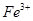 外还可能含有
外还可能含有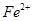 。若要确认其中的
。若要确认其中的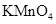 溶液
溶液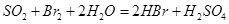 ,然后加入足量
,然后加入足量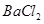 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中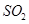 的体积分数为 。
的体积分数为 。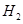 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。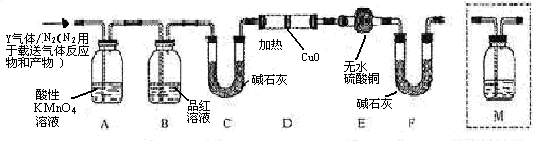
 O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1