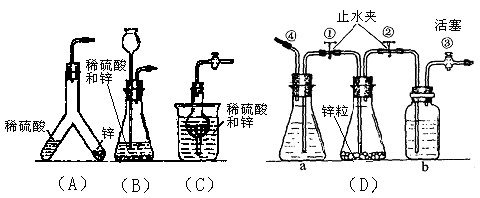
题目内容
下列实验方法和解释或结论都正确的是
| | 实验目的 | 实验方法 | 解释或结论 |
| A | 检验CH2=CH-CHO中含碳碳双键 | 将丙烯醛溶液滴入溴水中,溴水褪色 | 丙烯醛中碳碳双键与溴单质发生了加成反应 |
| B | 确认某无机酸浓溶液的溶质 | 用蘸有浓氨水的玻璃棒放于试剂瓶口,有大量白烟 | 该无机酸一定为盐酸 |
| C | 鉴别一份红棕色气体成分 | 湿润的淀粉碘化钾试纸插入气体中,试纸变蓝 | 该气体一定为Br2 |
| D | 探究高级脂肪酸甘油酯水解的条件 | 高级脂肪酸甘油酯中加入NaOH溶液加热后不再分层 | 高级脂肪酸甘油酯发生皂化反应 |
D
试题分析:碳碳双键、醛基都能使溴水褪色,后者被氧化为羧基,则该实验方法错误,不能选溴水,而应选溴的四氯化碳溶液,故A错误;浓盐酸、浓硝酸都易挥发,遇浓氨水挥发的氨气都能产生白烟,则该实验解释或结论错误,故B错误;Br2(g)、NO2都是红棕色气体,都能氧化KI,淀粉遇生成的I2变蓝,故C错误;高级脂肪酸甘油酯在NaOH溶液加热时完全水解,生成易溶于水的高级脂肪酸钠和甘油,前者是肥皂的主要成分,故D正确。

练习册系列答案
相关题目
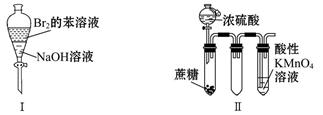
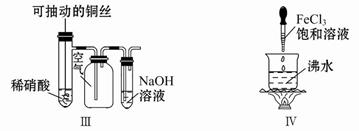
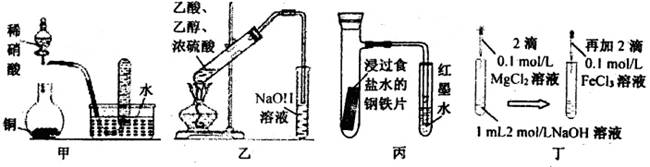

 浸出液
浸出液
 滤液
滤液
 ZnO
ZnO