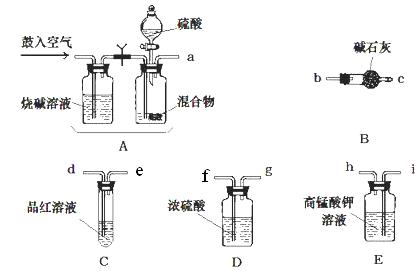
题目内容
为检验试管中少量白色晶体是否为硫酸铵,下列四位同学分别设计了四种方案,其中可行的方案是
| A.加入1 mLNaCl溶液,加热试管,将湿润的红色石蕊试纸靠近试管口 |
| B.加入1 mLNaCl溶液,加热试管,将湿润的蓝色石蕊试纸靠近试管口 |
| C.加入1 mLNaOH溶液,加热试管,将干燥的红色石蕊试纸靠近试管口 |
| D.加入1 mLNaOH溶液,加热试管,将湿润的红色石蕊试纸靠近试管口 |
D
试题分析:A、B项:不发生反应生成氨气,故错;C项:需要湿润的红色石蕊试纸,故错。故选D。
点评:本题主要考查了检验铵盐的方法,题目难度不大,旨在考查学生对基础知识的掌握。。

练习册系列答案
相关题目

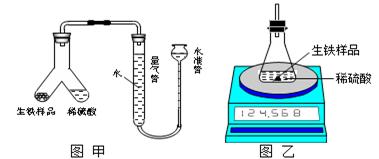
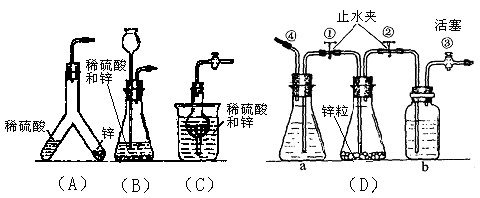
 。回答以下问题:
。回答以下问题: