题目内容
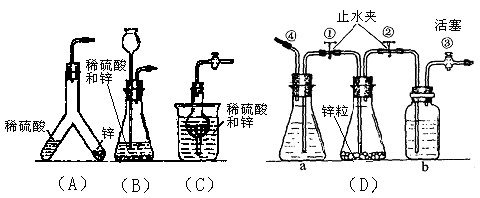
(共14分)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
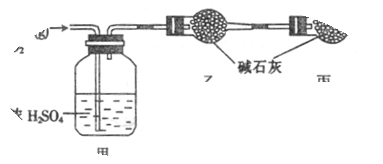
(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
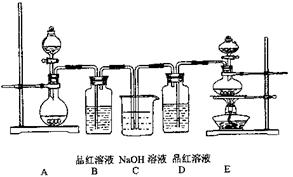
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
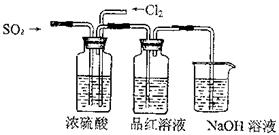
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?

(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
(1)MnO2+4H++2Cl- Mn2++Cl2↑+ 2H2O 还原性
Mn2++Cl2↑+ 2H2O 还原性
(2)B:溶液恢复红色 D:溶液不恢复红色
(3)吸收SO2和Cl2,防止污染空气
(4)①SO2+Cl2+2H2O=4H++SO42-+2Cl-
②控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1)
 Mn2++Cl2↑+ 2H2O 还原性
Mn2++Cl2↑+ 2H2O 还原性(2)B:溶液恢复红色 D:溶液不恢复红色
(3)吸收SO2和Cl2,防止污染空气
(4)①SO2+Cl2+2H2O=4H++SO42-+2Cl-
②控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1)
试题分析:(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应。该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色。氯气使品红褪色是氧化性漂白,不可还原,无法恢复。
点评:本题主要考查了二氧化硫的制备以及其相关性质的综合实验,解题过程中,应围绕课本基本知识,如“二氧化硫使品红溶液褪色”、“二氧化硫与氯气反应生成氯化氢和硫酸”等基础知识。同时,对于实验的设计,尤其是多因素影响的实验,应考虑“控制变量法”。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目