题目内容
【题目】我国是全钒液流电池最大生产国,产品出口美、欧、日等发达国家,市 场占有率全球第一。全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O![]() VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是
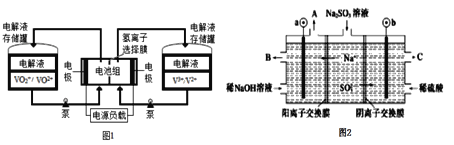
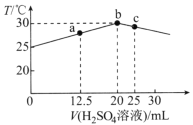
A.电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B.电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
C.电池放电时,负极电解液的pH升高
D.若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3阴极区变化的质量为4.5g
【答案】B
【解析】
图2中Na+移向a极,a是阴极,阴极电极反应: 4H++4e-=2H2↑,b是阳极,电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,所以a极与电池负极相连,图1中电池放电时,V3+→V2+,右边是正极,左边为负极,原电池中阳离子向正极移动,据此分析解答。
A.Na+移向a极,a是阴极,所以a极与电池负极相连,电池放电时,V3+→V2+,右边是正极,所以图1中H+从电池左边移向右边,故A错误;
B.SO32-移向b极,b是阳极,电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,故B正确;
C.电池放电时,负极失电子发生氧化反应,电极反应式为VO2+-e-+ H2O= VO2++ 2H+,根据电极反应可知,产生氢离子,负极电解液的pH降低,故C错误;
D.电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+,消耗12.6gNa2SO3的物质的量为![]() =0.1mol,转移0.2mol电子,有0.2molNa+移入阴极区,根据阴极电极反应: 4H++4e-=2H2↑,阴极生成0.1mol氢气,所以变化的质量为0.2mol×23g/mol-0.2g=4.4g,故D错误;
=0.1mol,转移0.2mol电子,有0.2molNa+移入阴极区,根据阴极电极反应: 4H++4e-=2H2↑,阴极生成0.1mol氢气,所以变化的质量为0.2mol×23g/mol-0.2g=4.4g,故D错误;
答案选B。