题目内容
【题目】用 0.1000 mol·L1 NaOH 溶液分别滴定 20.00 mL 0.1000 mol·L1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
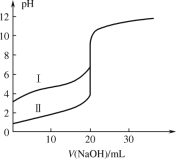
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH) = 10.00 mL 时,醋酸溶液中c(CH3COOH)<c(CH3COO)
C.pH = 7 时,滴定盐酸消耗的 NaOH 溶液体积小于滴定醋酸消耗的 NaOH 溶液体积
D.V(NaOH) = 20.00 mL 时,两溶液中 c(CH3COO)=c(Cl)
【答案】B
【解析】
A. 0.1000 mol·L1的盐酸和醋酸,盐酸的pH =1,醋酸的pH值大于1,因此Ⅰ、Ⅱ分别表示醋酸和盐酸的滴定曲线,故A错误;
B. V(NaOH) = 10.00 mL 时,所得溶液为等物质的量浓度的醋酸和醋酸钠的混合液,根据图中信息,溶液显酸性,醋酸电离程度大于醋酸根水解程度,因此溶液中c(CH3COOH)<c(CH3COO),故B正确;
C. pH = 7 时,滴定盐酸消耗的 NaOH 溶液体积为20.00mL,滴定醋酸消耗的 NaOH 溶液体积为20.00mL时,溶质为醋酸钠,溶液显碱性,要使得溶液的pH= 7 ,则加入的NaOH溶液体积小于20.00mL,因此滴定盐酸消耗的 NaOH 溶液体积大于滴定醋酸消耗的 NaOH 溶液体积,故C错误;
D. V(NaOH) = 20.00 mL 时,两溶液溶质分别为NaCl和CH3COONa,醋酸根水解,因此溶液中c(CH3COO)<c(Cl),故D错误;
综上所述,答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】从下列实验事实或操作所引出的相应结论正确的是( )
选项 | 实验事实或操作 | 结论 |
A | 其他条件相同, | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | 物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 开始时的反应速率相同 |
D | 在容积可变的密闭容器中发生反应 | 正反应速率加快,逆反应速率不变 |
A. AB. BC. CD. D