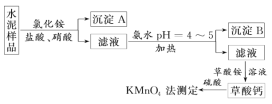
题目内容
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒
D.乙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
【答案】D
【解析】
A.Cr元素化合价由K2Cr2O7中的+6价降低为Cr3+中的+3价,则1molK2Cr2O7被还原为Cr3+转移的电子数为(6-3)×2=6mol,即6NA,故A错误;
B.1.0molCH4与Cl2在光照下反应,生成物是氯化氢和四种卤代烃,因此生成的CH3Cl分子数小于1.0NA,故B错误;
C.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol FeCl3形成的胶粒的个数小于NA个,故C错误;
D.乙烯和环丙烷的最简式均为CH2,故42g混合物中含有的CH2的物质的量n=![]() =3mol,则含6mol氢原子即6NA个,故D正确;
=3mol,则含6mol氢原子即6NA个,故D正确;
答案选D。

练习册系列答案
相关题目
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L