题目内容
【题目】某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
【答案】 2.0×10-7 8.0×10-11 8.0×10-11 高于
【解析】某温度下,纯水中的c(H+)=2.0×10-7molL-1,H2OOH-+H+,则c(OH-)=c(H+)=2.0×10-7molL-1,水的电离过程是吸热过程,常温下水电离出的离子浓度c(OH-)=c(H+)=1.0×10-7molL-1,所以此时温度高于25℃,若温度不变,Kw=c(OH-)×c(H+)=4.0×10-14(molL-1)2,不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=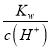 =
=![]() =8.0×10-11molL-1,溶液中由水电离出的c(OH-)=c(H+)=8.0×10-11molL-1。
=8.0×10-11molL-1,溶液中由水电离出的c(OH-)=c(H+)=8.0×10-11molL-1。

练习册系列答案
相关题目