题目内容
下列叙述中,不正确的是
| A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10 |
| B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在: c(Na+)>c(CH3COO-) >c(OH-)>c(H+) |
| D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L |
D
试题分析:A、pH=2与pH=1的CH3COOH溶液中,c(H+)分别为0.01mol/L、0.1mol/L,所以c(H+)之比为1 :10,正确;B、根据质子守恒规律,水电离产生的H+与CO32-结合生成HCO3-和H2CO3,而水电离产生的H+与OH-浓度相等,所以c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),正确;C、仅含Na+、H+、OH-、CH3COO-离子的某溶液可能是醋酸钠溶液,所以不水解的离子的浓度最大,其次是水解离子,再次是显性离子,最后是不显性离子,醋酸钠溶液显碱性,所以c(Na+)>c(CH3COO-) >c(OH-)>c(H+),正确;D、CH3COOH为弱酸,在水溶液中部分电离,所以0.1mol/ L的CH3COOH溶液中的c(H+) ≠0.1mol/L,则由水电离出的c(H+) ≠1×10-13mol/ L,错误,答案选D。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
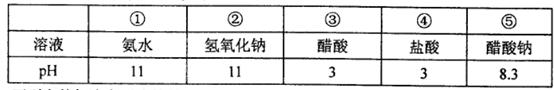
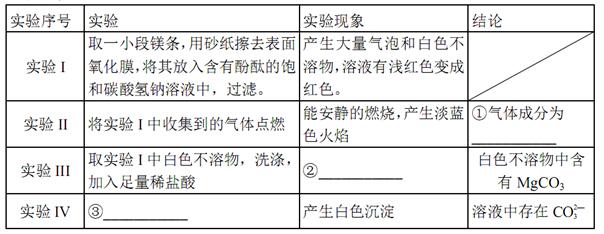
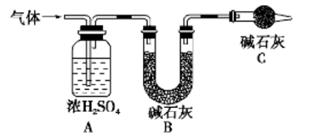
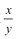 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”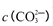
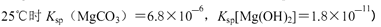
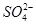
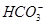
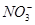 、
、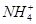 、Fe2+、Cl-
、Fe2+、Cl- CH3COO-+H+,下列关于醋酸说法错误的是
CH3COO-+H+,下列关于醋酸说法错误的是 H++A2-
H++A2-