题目内容
下列说法正确的是
| A.常温下,某溶液中由水电离出来的c(H+)=1×10―amol·L―1,若a<7,则该溶液可能为NaHSO4溶液 |
| B.中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸) >V(醋酸) |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.已知Ag2CrO4的Ksp为1.12×10-12,将等体积的1×10-4mol·L-1的AgNO3溶液和1×10-4mol·L-1K2CrO4溶液混合,会有Ag2CrO4沉淀产生 |
C
试题分析:A项,当a<7时,说明水的电离程度增大,即促进了水的电离,而NaHSO4电离产生的H+会抑制水的电离,故A项错误;B项,同体积、同pH的硫酸和盐酸溶液中n(H+)相等,与NaOH发生中和反应时所需同浓度的NaOH溶液的体积相等,同体积、同pH的盐酸和醋酸溶液中n(CH3COOH)>n(HCl),与NaOH发生中和反应时所需同浓度的NaOH溶液的体积:V(醋酸)>V(盐酸),所以题中的三个体积关系为V(硫酸)=V(盐酸)<V(醋酸),故B项错误;C项,pH相等说明c(OH-)相等,三种酸的酸性强弱关系为CH3COOH>H2CO3>C6H5OH,对应阴离子的水解难易程度为C6H5O->HCO3->CH3COO-,则水解产生的c(OH-)相等时,所需C6H5O-的浓度最小,而CH3COO-的浓度最大,进一步推得c(Na+)大小关系:②<③<①,故C项正确;D项,当AgNO3溶液与K2CrO4溶液等体积混合后,c(Ag+)= c(CrO4-)=0.5×10-4mol·L-1,则c2(Ag+)? c(CrO4-)= (0.5×10-4)3=0.125×10-12<1.12×10-12=Ksp,所以此时没有Ag2CrO4沉淀产生,故D错误。

练习册系列答案
相关题目
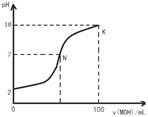
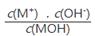 不变
不变 Al(OH)3↓
Al(OH)3↓