题目内容
(16分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁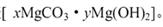
(2)定性实验
(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中:
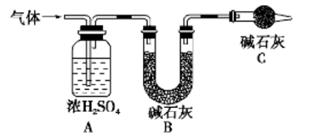
①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致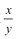 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”
(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中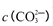
为(已知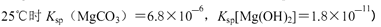
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁
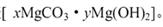
(2)定性实验

(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中:

①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致
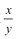 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中
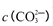
为(已知
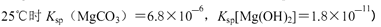
(16分)
(1)Mg(OH)2(1分)
(2)①氢气(1分) ②沉淀溶解,产生气泡(2分)
③取实验I中的澄清溶液少许于试管中,加入少量CaCl2溶液(2分)
(3)①MgCO3?Mg(OH)2[或Mg(OH)2?MgCO3或Mg2(OH)2CO3](2分)
②防止空气中的水蒸气和二氧化碳进入装置B引起实验误差(2分)
偏大(1分)
(4)①NaHCO3溶液中存在平衡:HCO3? H++CO32?;H2O
H++CO32?;H2O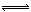 H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)
H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)
② 3.8×10-3mol?L?1(2分)
(1)Mg(OH)2(1分)
(2)①氢气(1分) ②沉淀溶解,产生气泡(2分)
③取实验I中的澄清溶液少许于试管中,加入少量CaCl2溶液(2分)
(3)①MgCO3?Mg(OH)2[或Mg(OH)2?MgCO3或Mg2(OH)2CO3](2分)
②防止空气中的水蒸气和二氧化碳进入装置B引起实验误差(2分)
偏大(1分)
(4)①NaHCO3溶液中存在平衡:HCO3?
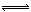 H++CO32?;H2O
H++CO32?;H2O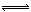 H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)
H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)② 3.8×10-3mol?L?1(2分)
试题分析:(1)对比猜想②③,可知猜想①白色不溶物可能为Mg(OH)2.
(2)①气体能安静的燃烧,产生淡蓝色火焰,所以该气体为H2。
②结论为白色不溶物中含有MgCO3,所以加入足量稀盐酸,实验现象为:沉淀溶解,产生气泡。
③证明溶液中含有CO32?,所以现象为产生白色沉淀,所以实验操作为:取实验I中的澄清溶液少许于试管中,加入少量CaCl2溶液。
(3)①装置A增重1.8 g,生成了H2O为0.1mol,装置B增重4.4 g,生成CO2的物质的量为0.1mol,则白色不容物含有等物质的量的Mg(OH)2和MgCO3,所以白色不溶物的化学式为:MgCO3?Mg(OH)2[或Mg(OH)2?MgCO3或Mg2(OH)2CO3]
②装置C中含有碱石灰,能吸收水分和CO2,所以其作用为防止空气中的水蒸气和二氧化碳进入装置B引起实验误差;若移除装置C外界,空气中的水蒸气和二氧化碳进入装置B,而装置B增加的质量为产生的CO2的质量,所以造成测量的MgCO3的质量增大,导致
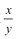 的值偏大。
的值偏大。(4)①NaHCO3溶液中存在两个电离平衡:HCO3?
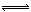 H++CO32?;H2O
H++CO32?;H2O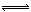 H++OH?,加入Mg后,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3。
H++OH?,加入Mg后,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3。②pH为10,则c(OH?)=10-4mol?L?1,c(Mg2+)=Ksp[Mg(OH)2]÷c2(OH?)=1.8×10-11÷(10-4)2=1.8×10-3,c(CO32?)=" K" sp[MgCO3]÷c(Mg2+)=6.8×10-6÷(1.8×10-3)= 3.8×10-3mol?L?1sp的计算。

练习册系列答案
相关题目

 NH3 ·H2O
NH3 ·H2O