题目内容
【题目】下列实验过程中产生的现象与图形相符合的是
A. 稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B. 铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C. CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
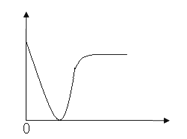
D. 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
【答案】D
【解析】
A、稀盐酸滴加到一定量NaOH溶液中,钠离子不参加反应,物质的量不变,与图形不符,A错误;
B、由Fe+CuSO4=FeSO4+Cu可知,铁置换出了等物质的量的铜,固体的质量增大,反应停止后,保持不变,与图形不符,B错误;
C、依次发生的反应为:CO2+2NaOH=Na2CO3+H2O CO2+NaOH=NaHCO3,而溶液导电性与离子浓度及离子所带电荷有关,从反应可知,溶液导电性基本上没有太大的改变,与图形不符,C错误;
D、由反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,随着硫酸的滴加,生成了沉淀与水,溶液的导电能力逐渐减小到最弱,继续滴加,相当于是硫酸溶液,导电性再基本恢复,与图形相符,D正确;
答案选D。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目