题目内容
【题目】消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
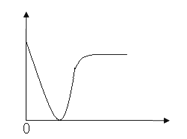
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______

A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g)![]() NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g)![]() SO3(g)+O2(g)
SO3(g)+O2(g)
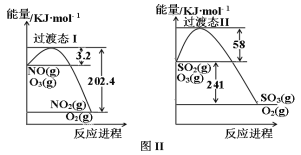
已知该体系中温度80℃以上臭氧发生分解反应:2O3![]() 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
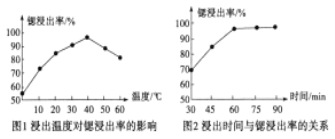
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:
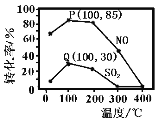
①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L1·s1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
【答案】CD B NO(g)+O3(g)![]() NO2(g)+O2(g) ΔH=199.2kJ·mol1 小于 NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案
NO2(g)+O2(g) ΔH=199.2kJ·mol1 小于 NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案 ![]() 0.96(或0.95)
0.96(或0.95)
【解析】
II(1)根据△H=反应物的总键能-生成物的总键能,计算反应热;根据△G=△H-T△S>0,判断;
(2)根据![]() 计算反应速率;
计算反应速率;
利用![]() 计算平衡常数。
计算平衡常数。
I (1) 4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g);
5N2(g)+6H2O(g);
A、达到化学平衡时,正反应速率等于逆反应速率,用不同物质表示时,数值要成比例;选项中有正反应速率,有逆反应速率,但是4υ正(NH3)=5υ逆(N2),表示的正逆反应速率不相等,应该为![]() ,A错误;
,A错误;
B、体积不变,气体的质量不变,根据![]() ,则密度一直不变,则密度不变不能说明达到平衡,B错误;
,则密度一直不变,则密度不变不能说明达到平衡,B错误;
C、恒温恒压下,压强和物质的量成正比,反应前后物质的量在改变,说明压强会变,等压强不变的时候,说明反应达到了平衡,C正确;
D、根据![]() ,气体质量不变,气体物质的量变化,说明平均摩尔质量在变,当平均摩尔质量不变时,说明达到了平衡,D正确;
,气体质量不变,气体物质的量变化,说明平均摩尔质量在变,当平均摩尔质量不变时,说明达到了平衡,D正确;
答案选CD;
(2)a状态转为b状态,由图像可知,b状态达到平衡的时间更短,说明化学反应速率更快,NO的转化率更低,说明a状态到b状态,平衡逆向移动;
A、降低温度,化学反应速率变小,达到平衡的时间变长,不符合题意;B、增大NO的浓度,化学反应速率增大,达到平衡的时间变短,NO的转化率降低,B符合题意;
C、加入催化剂,NO的转化率不变,C不符合题意;
D、向密闭容器中通入氩气,各反应物的浓度不变,则平衡不移动,D不符合题意;
答案选B;
II (1) (1)根据△H=反应物的总键能-生成物的总键能,△H=3.2kJ、mol-202.4kJ·mol-1=199.2KJ·mol1,则反应Ⅰ的热化学方程式为NO(g)+O3(g)![]() NO2(g)+O2(g) ΔH=199.2KJ·mol1;
NO2(g)+O2(g) ΔH=199.2KJ·mol1;
反应1在高温下不能自发进行,则△G>0,根据△G=△H-T△S>0,△H<0,则△S>O;
(2)①NO和SO2均和O3发生反应,但是NO的转化率比SO2转化率高,可能由反应物本身的性质决定的;根据图示,可以知道NO与O3反应的活化能低于SO2与O3反应的活化能,使得NO反应速率快,再与O3反应中,更具优势,反应的更多;答案为NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案;
t秒时反应1进行到P点,NO的转化率为85%,加入了1mol NO,则反应了0.85molNO, ![]() ;
;
②100℃下反应2的平衡常数![]() ,体积为1L。需要知道各物质的物质的量,由于O3和O2涉及到3个反应,要综合计算,
,体积为1L。需要知道各物质的物质的量,由于O3和O2涉及到3个反应,要综合计算,

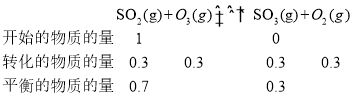
100℃时臭氧的分解率约为10%,

则平衡时O3的物质的量=2mol-0.85mol-0.3mol-0.2mol=0.65mol;平衡时O2的物质的量=0.85mol+0.3mol+0.3mol =1.45mol;则带入数据,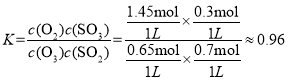 。
。