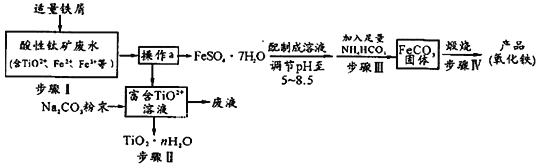
题目内容
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. T的氢化物的沸点一定高于同主族元素形成的其他氢化物
D. T元素单质具有半导体的特性,T与Z元素可形成化合物TZ4
【答案】D
【解析】
假设原子最外层电子数分别是:W:a;X:a+1,Y:a+2;Z:a+3。则根据题意可得4a+6=22,解得a=4。所以W是Si;X是N;Y是O;Z是Cl;T是Ge,据此答题。
A.X、Y、Z三种元素最低价氢化物的沸点由低到高的顺序是:H2O>NH3>HCl,故A错误;
B.由X、Y和氢三种元素形成的化合物HNO3中只有共价键,而化合物NH4NO3中既含有离子键,也含有共价键,故B错误;
C.Ge和碳在同一主族,碳的氢化物种类繁多,其沸点随碳原子数的增加而升高,所以T的氢化物的沸点不一定高于同主族元素形成的其他氢化物,故C错误;
D.T元素在元素周期表中位于金属与非金属的交界区,单质具有半导体的特性,根据T与Z元素的原子结构可知二者可形成化合物TZ4,故D正确。
故选D。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目