题目内容
【题目】室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. M点时, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常温下,Ka2(H2C2O4)=10-1.3
D. ![]() 随pH的升高而减小
随pH的升高而减小
【答案】A
【解析】
A.电荷守恒2c(HC2O4-)+c(C2O42-)+ c(OH-)=c(Na+)+c(H+),M点pH=4.3偏酸性,c(OH-)<c(H+),所以2c(HC2O4-)+c(C2O42-)>c(Na+),故A正确;
B.因为pc=-lg c,所以纵坐标越大,浓度越小,根据图示可知,pH=x时,应该是c(HC2O4-)>c(H2C2O4)=c(C2O42-),故B不正确;
C.根据图示pH=1.3的点计算,Ka1(H2C2O4)=![]() =c(H+)=10-1.3,故C不正确;
=c(H+)=10-1.3,故C不正确;
D. 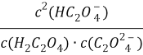 = Ka1(H2C2O4)/ Ka2(H2C2O4),K只与温度有关,温度不变就是定值,故D不正确;
= Ka1(H2C2O4)/ Ka2(H2C2O4),K只与温度有关,温度不变就是定值,故D不正确;
正确答案A。

【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
【题目】我国古代劳动人民在生产生活中积累了丰富的经验,很多生产过程的操作方法与化学实验中的物质分离除杂方法相似。下列加有着重号的文字与对应分离方法正确的是( )
《本草集经注》 | 《通州煮海录》 | 《名医别录》 | 《续遵义府志》 |
凡渍药酒,皆须细切……便可漉出 | 海陆取卤,日晒火煎,煮海熬波,卤水成盐 | 凡煮汤,欲微火,令小沸……箅渣取液 | 经月画出蒸之……终乃得酒可饮 |
|
|
|
|
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸发、过滤、蒸馏