题目内容
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的简化电子排布式为________。
(2)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是_____(填化学式,写一种)。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42—中S原子的杂化方式为____,用价层电子对互斥理论解释SO32—的键角比SO42—键角小的原因___________________________________________________。
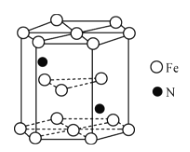
(4)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为____。
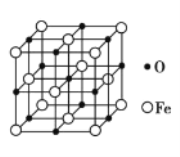
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为____;Fe2+与O2—的最短核间距为____pm。
【答案】[Ar]3d5 10 CN-或C22- SP3杂化 SO32-中孤电子对对成键电子对的排斥比SO42-中的成键电子对间的排斥作用大 3:1 12 (36/ρ×NA)1/3×1010
【解析】
(1)基态Fe2+简化的电子排布式为[Ar]3d6;
(2)[Fe(CO)5]分子中CO分子含有一个σ键,每个CO分子与Fe原子之间有一个σ键,共10个σ键;根据等电子体的概念得出与CO互为等电子体的离子的化学式为CN-或C22-;
(3)根据SO42-的VSEPR模型为正四面体,没有孤电子对,S原子的杂化方式是sp3杂化;SO32-中孤对电子对对成键电子对的排斥作用比SO42-中成键电子对间的排斥作用大;
(4)用“均摊法”,晶胞中含铁:12×1/6+2×1/2+3=6个,含氮:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1;
(5)根据晶胞,Fe2+为面心立方,与Fe2+紧邻且等距离的Fe2+数目为12个;晶胞参数等于相邻两个离子核间距的2倍。
(1)基态Fe2+简化的电子排布式为[Ar]3d6,故答案为:[Ar]3d6。
(2)[Fe(CO)5]分子中CO分子含有一个σ键,每个CO分子与Fe原子之间有一个σ键,共10个σ键,所以1mol[Fe(CO)5]分子中含有10mol的σ键,与CO互为等电子体的离子的化学式为CN-或C22-,
故答案为:10,CN-或C22-。
(3)SO42-的VSEPR模型为正四面体,没有孤电子对,S原子的杂化方式是sp3,SO42-中S原子的杂化方式为sp3杂化;用价层电子对互斥理论解释SO32-的键角比SO42-键角小的原因:SO32-中孤对电子对对成键电子对的排斥作用比SO42-中成键电子对间的排斥作用大,
故答案为:sp3杂化;SO32-中孤电子对对成键电子对的排斥比SO42-中的成键电子对间的排斥作用大。
(4)氮化铁晶胞为六棱柱,顶点贡献率为1/6,棱点贡献率为1/3,面点贡献率为1/2,观察晶胞可知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,2个N位于体内,用“均摊法”可知,1个晶胞中含铁微粒数:12×1/6+2×1/2+3=6个,含氮微粒数:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1,
故答案为:3:1。
(5)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍。上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,用“均摊法”,晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶胞的化学式为FeO,氧化亚铁中氧离子、亚铁离子个数比为1:1,所以,有12个Fe2+与Fe2+紧邻且等距离。1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短核间距为dpm,1molFeO的质量为72g,氧化亚铁晶体的密度为ρgcm-3,则有ρ=m/V=72×4/NA(2d×10-10)3,解得d=(36/ρ×NA)1/3×1010pm,所以Fe2+与O2-的最短核间距为(36/ρ×NA)1/3×1010pm,故答案为:12;(36/ρ×NA)1/3×1010pm。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】我国古代劳动人民在生产生活中积累了丰富的经验,很多生产过程的操作方法与化学实验中的物质分离除杂方法相似。下列加有着重号的文字与对应分离方法正确的是( )
《本草集经注》 | 《通州煮海录》 | 《名医别录》 | 《续遵义府志》 |
凡渍药酒,皆须细切……便可漉出 | 海陆取卤,日晒火煎,煮海熬波,卤水成盐 | 凡煮汤,欲微火,令小沸……箅渣取液 | 经月画出蒸之……终乃得酒可饮 |
|
|
|
|
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸发、过滤、蒸馏