题目内容
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:
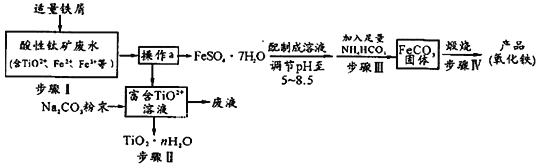
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________。
(2)步骤Ⅰ中加入铁屑的作用是________________________。(以离子方程式表示)
(3)操作a是_________ 、__________、过滤、洗涤、干燥 。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,所得的FeCO3中没有Fe(OH)2。则溶液中c(Fe2+)小于________ mol/L。步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是___________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合平衡移动原理和化学用语解释其原因_________________________________。
【答案】+4 Fe + 2Fe3+ = 3Fe2+ 蒸发浓缩 冷却结晶 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 避免温度过高碳酸氢铵分解,减少Fe2+的水解或氧化 8×10-5 向反应容器中补充适量的空气 溶液中存在水解平衡TiO2++(n+1)H2OTiO2nH2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2nH2O的方向移动
【解析】
钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液PH5-5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O![]() TiO2·n H2O+2H+向生成TiO2·n H2O的方向移动,可得到TiO2粗产品。
TiO2·n H2O+2H+向生成TiO2·n H2O的方向移动,可得到TiO2粗产品。
(1)离子中各元素化合价代数和等于离子所带电荷数,元素为-2价,则TiO2+钛的化合价为+4价。
(2)加入铁粉,首先发生Fe+2Fe3+=3Fe2+,其次发生Fe+2H+=Fe2++H2;
(3)操作a是溶液中得到溶质固体,方法是蒸发浓缩、冷却结晶过滤洗涤、干燥;
(4)步骤Ⅲ中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑,反应温度一般需控制在35℃以下,是为了避免温度过高碳酸氢铵分解,减少铁离子的水解程度;
(5)室温下测得溶液的pH为8.5,c(OH-)=10-14/10-8.5=1×10-5.5,由题中数据可知,溶液中c(Fe2+)·c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=8×10-16,故无Fe(OH)2沉淀生成;
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2OTiO2nH2O+2H+向生成TiO2·n H2O的方向移动,可得到TiO2粗产品.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视

