题目内容
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)双氧水的结构式为: ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)
(14分)(1)H-O-0-H Na2SO3 (各2分)
(2)2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3)H2SO4 阳(2分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O。 (2分)
ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O(2分)
(5)相同(2分)
解析试题分析:⑴H2O2中两个氧原子间形成一个共用电子对,结构式为:H―O―O―H,反应I:2ClO3―+SO32―+2H+=2ClO2+SO42―+H2O,其中SO32―中S由+4价变成+6价,作还原剂,格答案为:H―O―O―H;Na2SO3 ;⑵从图中读出反应物为ClO2和H2O2,碱性条件,产物为NaClO2,ClO2作氧化剂,H2O2中氧由―1价变成―2,2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O,故答案:2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;⑶Ⅲ阳极:2H2O―4e―=4H+ +O2↑,a为O2,阴极:4H2O+4e―=4OH― +2H2↑, b为H2, A的化学式是H2SO4, 装置Ⅲ中A在阳极区产生,答案:H2SO4、阳;⑷Cl―浓度大时,还原性增强,被生成的ClO2氧化,5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O。答案为:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O;⑸ClO2―、ClO3―与Fe2+ 反应最终都变成Cl―,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。答案:相同。
考点:物质的制备实验的工业设计、质量守恒和电子守恒

在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是
| A.防止氯气扩散到空气中造成污染 | B.便于控制加入盐酸的量 |
| C.长颈漏斗不便于添加液体 | D.尽量避免HCl挥发到空气中 |
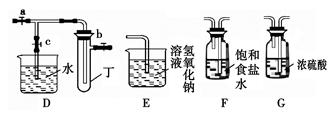
下列各组气体在常温下能共存且能用向上排空气法收集的是
| A.NO和O2 | B.HCl和NH3 | C.H2和CO | D.SO2和CO2 |
同一种制备装置可用于制取不同的气体,若只用如图装置制取气体,则: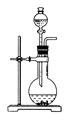
(1)请在下表空格中填上所需药品。
| 所制气体 | 药品 | |
| 分液漏斗内 | 烧瓶中 | |
| O2 | | MnO2 |
| H2 | 稀H2SO4 | |
| NH3 | | CaO |
| NO | 稀HNO3 | Cu |
| CO2 | 稀H2SO4 | 石灰石 |
| C2H4 | C2H5OH | 稀H2SO4 |
| C2H2 | | CaC2 |
(2)写出表中药品制备O2的化学方程式 。
(3)写出表中药品制备C2H2的化学方程式 。
(4)请画出干燥NH3的装置图,并标明干燥剂和气体流向。
(5)表中给全药品的项目中,不能用于制备相应气体的有(可不填满)。
①气体 ,理由 。
②气体 ,理由 。
③气体 ,理由 。
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2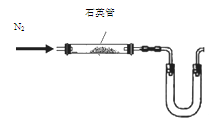
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
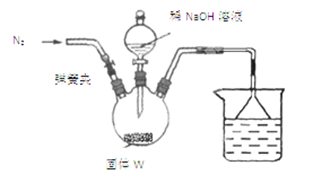
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。


 。
。 CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。

