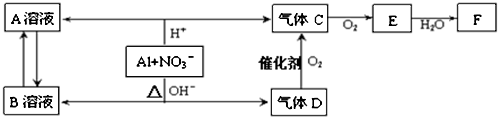
题目内容
7.NA为阿伏加德罗常数,下列说法错误的是( )| A. | 0.1 mol的甲基(-CH3)与羟基(-OH)所含电子数均为NA | |
| B. | 1molD216O中含中子、质子、电子各10NA | |
| C. | 32 g S8单质(分子结构如右图)中含有的S-S键个数为NA | |
| D. | 1.5g CH3+中含有的电子数为0.8NA |
分析 A、甲基和羟基均不带电荷;
B、D216O中含10个中子、10个质子和10个电子;
C、求出S8单质的物质的量,然后根据1molS8单质中含8molS-S键来分析;
D、求出CH3+的物质的量,然后根据1molCH3+中8mol电子来分析.
解答 解:A、甲基和羟基均不带电荷,即甲基和羟基中均含9个电子,则0.1mol甲基和0.1mol羟基中均含0.9mol电子即0.9NA个,故A错误,
B、D216O中含10个中子、10个质子和10个电子,故1molD216O中含中子、质子、电子各10NA,故B正确;
C、32gS8单质的物质的量为n=$\frac{32g}{32×8g/mol}$=$\frac{1}{8}$mol,而1molS8单质中含8molS-S键,故$\frac{1}{8}$molS8单质中含1molS-S键即NA个,故C正确;
D、1.5gCH3+的物质的量为0.1mol,而1molCH3+中8mol电子,故0.1mol中含0.8mol电子即0.8NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
17.A和B两种有机物可以互溶,有关性质如下:
(1)要除去A和B的混合物中的少量A,可采用A方法即可得到B.
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
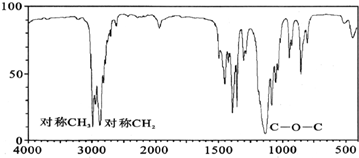
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g.计算混合物中A和B的物质的量之比1:1.
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)若B的分子式为C2H6O,核磁共振氢谱表明其分子中有三种化学环境不同的氯原子,强度之比为3:2:1.则B的结构简式为CH3CH2OH.
(3)若质谱图显示A的相对分子质量为74,红外光谱如图所示,则A的结构简式为CH3CH2OCH2CH3.

(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g.计算混合物中A和B的物质的量之比1:1.
19.用氢氧化钠固体配制一定物质的量浓度溶液,下列情况使结果偏低的是( )
| A. | 容量瓶内含少量水 | B. | 氢氧化钠中含有少量碳酸钠 | ||
| C. | 俯视定容 | D. | 溶解后立即定容 |
16.甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率.(填“大于”、“小于”或“等于”)
| 化学方程式 | 焓变 △H/(kJ•mol-1) | 活化能 Ea/(kJ•mol-1) | |
| 甲烷氧化 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)═CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)═CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)═CO2(g)+4H2(g) | +165.0 | 243.9 |
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率.(填“大于”、“小于”或“等于”)
 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液. A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: