题目内容
18.已知:①2H2(g)+O2(g)=2H2O(l)△H1=-a kJ•mol-1②2CO(g)+O2(g)=2CO2(g)△H2=-b kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-c kJ•mol-1
计算甲醇蒸气的标准燃烧热△H=-(a+$\frac{1}{2}$b-c)kJ•mol-1.
分析 已知①2H2(g)+O2(g)=2H2O(l)△H1=-akJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-bkJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-ckJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2O(l).
解答 解:已知:①2H2(g)+O2(g)=2H2O(l)△H1=-akJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-bkJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-ckJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2O(l);
△H=-akJ•mol-1-bkJ•mol-1×$\frac{1}{2}$+ckJ•mol-1=-(a+$\frac{1}{2}$b-c)kJ•mol-1,
故答案为:-(a+$\frac{1}{2}$b-c)kJ•mol-1.
点评 本题考查了盖斯定律在计算中的应用,题目难度不大,注意把握分方程式与目标方程式的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
6.下列有关化学用语的理解错误的是( )
| A. | 电子式 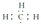 可以表示甲基,但不能表示CH3+ 可以表示甲基,但不能表示CH3+ | |
| B. | 比例模型 既能表示甲烷分子,也能表示四氯化碳分子 既能表示甲烷分子,也能表示四氯化碳分子 | |
| C. | C2H4O2可以表示乙酸、甲酸甲酯等物质 | |
| D. | 离子结构示意图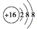 可以表示32S2-,也可以表示34S2- 可以表示32S2-,也可以表示34S2- |
13.下列说法不正确的是( )
| A. | 探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 | |
| D. | 取皂化反应后的混合液滴入热水中,观察现象,可判断皂化反应是否完全 |
3.在下列变化中,需加入氧化剂才能进行的是( )
| A. | KMnO4→MnO2 | B. | Na2CO3→CO2 | C. | Fe2+→Fe | D. | CO→CO2 |
10.把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3 全部赶出.另一份需消耗含cmolBaCl2的水溶液,沉淀反应刚好完全.则原溶液中硝酸根离子的物质的量浓度为( )
| A. | $\frac{b-2c}{a}$mol.L-1 | B. | $\frac{2b-c}{a}$mol.L-1 | C. | $\frac{a-b}{a}$mol.L-1 | D. | $\frac{2b-4c}{a}$mol.L-1 |
7.NA为阿伏加德罗常数,下列说法错误的是( )
| A. | 0.1 mol的甲基(-CH3)与羟基(-OH)所含电子数均为NA | |
| B. | 1molD216O中含中子、质子、电子各10NA | |
| C. | 32 g S8单质(分子结构如右图)中含有的S-S键个数为NA | |
| D. | 1.5g CH3+中含有的电子数为0.8NA |
8.国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油.已知热化学方程式:$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(l)△H=-683.4kJ/mol.下列有关说法正确的是( )
| A. | 乙醇汽油是一种清洁能源,燃烧不会产生任何污染 | |
| B. | 在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 | |
| C. | 乙醇的燃烧热为683.4kJ/mol | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol |