题目内容
12. A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:(1)F的基态原子电子排布式为1s22s22p63s23p63d84s2.
(2)B、C、D的原子的第一电离能由小到大的顺序为C<O<N(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是b.
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
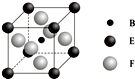
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为8,该晶体的化学式为MgNi3C.
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
分析 A、B、C、D、E、F、G七种元素的原子序数依次增大.其中B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为碳元素;A的最高正价和最低负价的绝对值相等,原子序数小于碳,故A为H元素;E的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素,故E为Mg,而C的原子序数介于碳、氧之间,则C为N元素;F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故F为Ni,G2+的3d轨道有9个电子,则G为Cu,据此解答.
解答 解:A、B、C、D、E、F、G七种元素的原子序数依次增大.其中B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为碳元素;A的最高正价和最低负价的绝对值相等,原子序数小于碳,故A为H元素;E的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素,故E为Mg,而C的原子序数介于碳、氧之间,则C为N元素;F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故F为Ni,G2+的3d轨道有9个电子,则G为Cu.
(1)F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,3d能级有8个电子,故原子核外电子排布为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)C、N、O同周期,随原子序数增大的第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为C<O<N,
故答案为:C<O<N;
(3)a.C2H2分子中含有C≡C三键、C-H键,含有σ键和π键,而H2O2分子为H-O-O-H,只含有σ键,故a错误;
b.C2H2常温下为气态,而H2O2常温下为液态,故b正确;
c.C2H2、H2O2均含有极性键、非金属性,C2H2是直线型对称结构,是非极性分子,而H2O2分子是展开书页形结构,属于极性分子,故c错误;
d.C2H2分子、H2O2分子含有电子总数或价电子总数不相等,不是等电子体,故d错误;
e.C2H2分子中C原子成2个σ键、没有孤对电子,杂化轨道数目为2,采取sp杂化,H2O2分子中O原子成2个σ键、含有2对孤电子对,杂化轨道数目为4,采取sp3杂化,故e错误;
故选答案为:b;
(4)以上底面面心F原子研究,与之距离最近的F原子位于晶胞两个侧面及前后面面心上,而晶胞上底面为上层晶胞的下底面,故与之最近的F原子有8个;
由晶胞晶胞可知,晶胞中C原子数目=1、Ni元素数目=6×$\frac{1}{2}$=3、Mg原子数目=8×$\frac{1}{8}$=1,故该晶体的化学式为MgNi3C,
故答案为:8;MgNi3C;
(5)向CuSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,沉淀消失的离子反应方程式:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评 本题考查物质结构与性质,涉及核外电子排布、电离能、分子结构与性质、配合物、晶胞结构与计算等,学生要熟练掌握基础知识并能迁移运用,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| A. | KMnO4→MnO2 | B. | Na2CO3→CO2 | C. | Fe2+→Fe | D. | CO→CO2 |
| A. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| B. | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 | |
| C. | H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 | |
| D. | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
| A. | 0.1 mol的甲基(-CH3)与羟基(-OH)所含电子数均为NA | |
| B. | 1molD216O中含中子、质子、电子各10NA | |
| C. | 32 g S8单质(分子结构如右图)中含有的S-S键个数为NA | |
| D. | 1.5g CH3+中含有的电子数为0.8NA |
| A. | 硝酸钠固体 | B. | 冰醋酸 | C. | 硫酸锌溶液 | D. | 硫酸铜固体 |
| A. | s区的元素都是活泼的金属元素 | B. | 所有的非金属元素都在p区 | ||
| C. | d区、ds区全是金属元素 | D. | 镧系、锕系元素都在f区 |