题目内容
【题目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
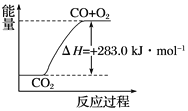
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
【答案】B
【解析】
本题考查的是燃烧热和和热化学方程式的含义,根据定义进行分析即可。
A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,水的稳定状态为液态,故燃烧热不是241.8 kJ·mol-1,故错误;B.热化学方程式中的系数表示物质的量,所以CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的含义为1 mol CO(g)和
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的含义为1 mol CO(g)和 ![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量,故正确;C.反应为放热反应,但图像表示的为吸热反应,故错误;D.反应物和生成物相反,则反应热的符号改变,所以分解1 mol H2O(g),其反应热为+241.8 kJ,故错误。故选B。
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量,故正确;C.反应为放热反应,但图像表示的为吸热反应,故错误;D.反应物和生成物相反,则反应热的符号改变,所以分解1 mol H2O(g),其反应热为+241.8 kJ,故错误。故选B。

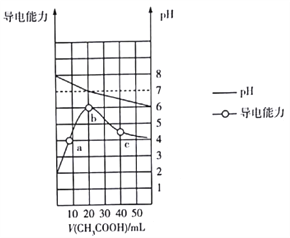
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是 , 溶液中各离子浓度大小的关系是。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。