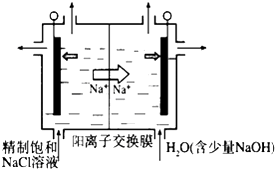
��Ŀ����
����Ŀ������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±��dz����¼���������ʵĵ���ƽ�ⳣ����
���� | ���볣��(Ka��Kb) | �ѣ������� | �ܶȻ�������Ksp�� |
CH3COOH | 1��8��10��5 | BaSO4 | 1��10-10 |
HNO2 | 4��6��10��4 | BaCO3 | 2.6��10-9 |
HCN | 5��10��10 | CaSO4 | 7��10-5 |
HClO | 3��10��8 | CaCO3 | 5��10-9 |
NH3��H2O | 1��8��10��5 |
��ش��������⣺
��1�������������У������������� (�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ���̶��������볣������IJ�����(�����)��
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ�� (ѡ����ԡ������ԡ����ԡ�)�������� �� ��Һ�и�����Ũ�ȴ�С�Ĺ�ϵ����
��3�����ʵ���1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı��Σ��磺BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42-���ʵ���Ũ�ȴﵽ0.01mol��L-1���ϣ�����Һ��CO32-���ʵ���Ũ��Ӧ ��mol��L-1��
���𰸡�
��1��HCN��B
��2�����ԣ��������1�еĵ���ƽ�ⳣ��������ĺ�NH3H2O�ĵ���ƽ�ⳣ����ͬ������CH3COO-��NH4+��ˮ��ƽ��̶���ͬ��c(NH4+)=c(CH3COO-)>c(OH-)=c(H+)
��3��c(Na+)>c(CN-)>c(OH-)>c(H+)
��4��0.26
����������(1)����һԪ���ᣬ����ƽ�ⳣ��Խ��������Խǿ����֮������Խ����HCN�ĵ���ƽ�ⳣ����С�����������������ݴ���ĵ���ƽ�⣺CH3COOH ![]() CH3COO-+H+��
CH3COO-+H+��
A�������¶ȣ�����̶�������ƽ�ⳣ������A����
B����ˮϡ�ͣ�����̶�������ƽ�ⳣ�����䣬��B��ȷ��
C����������CH3COONa���壬������Ĵ�����Դ���ĵ���ƽ�����������ã�����̶ȼ�С������ƽ�ⳣ�����䣬��C����
D�������������ᣬ�����Ũ��������ԽϡԽ�������ʵ�������̶ȼ�С��ƽ�ⳣ�����䣬��D����
(2)�������Һ�У�����ˮ���Լ��ԣ�笠�����ˮ�������ԣ�CH3COOH��NH3H2O�ĵ���ƽ�ⳣ����ȣ�CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ�����Ժͼ��Գ̶��൱����Һ�����ԣ���c(H+)=c(OH-)�����ݵ���غ㣺c(NH4+)+c(H+)=c(Cl-)��c(H+)=c(OH-)��c(H+)+c(NH4+)=c(Cl-)+c(OH-)���ó�c(NH4+)=c(Cl-)���Ҵ���ˮ�����ɵ�c(H+)��c(OH-)����c(NH4+)=c(CH3COO-)��c(H+)=c(OH-)��
(3)���ʵ���֮��Ϊ1��1��NaCN��HCN�Ļ����Һ����pH��7��˵����������ӵ�ˮ��̶ȴ���������ĵ���̶ȣ�������ҺC(OH-)��C(H+)���ʼ��ԣ����ݵ���غ�֪��C(OH-)+c(CN-)=C(H+)+C(Na+)������c(CN-)��C(Na+)�����Ը�����Ũ�ȴ�С˳����C(Na+)��c(CN-)��C(OH-)��C(H+)��
(4)SO42-���ʵ���Ũ��Ϊ0.01molL-1ʱ�������ӵ�Ũ��Ϊ��c(Ba2+)= ![]() mol/L=1��10-8mol/L����ʹSO42-���ʵ���Ũ�Ȳ�С��0.01molL-1 �� ������Ũ��Ӧ�ô���1��10-8mol/L����������Ũ��Ϊ1��10-8mol/Lʱ������Һ��̼�������Ũ��Ϊ��
mol/L=1��10-8mol/L����ʹSO42-���ʵ���Ũ�Ȳ�С��0.01molL-1 �� ������Ũ��Ӧ�ô���1��10-8mol/L����������Ũ��Ϊ1��10-8mol/Lʱ������Һ��̼�������Ũ��Ϊ�� ![]() mol/L=0.26mol/L�����Ե�̼�������Ũ�ȡ�0.26mol/Lʱ��������Ũ��С��1��10-8mol/L����SO42-���ʵ���Ũ�Ȳ�С��0.01mol/L��
mol/L=0.26mol/L�����Ե�̼�������Ũ�ȡ�0.26mol/Lʱ��������Ũ��С��1��10-8mol/L����SO42-���ʵ���Ũ�Ȳ�С��0.01mol/L��
�ʴ�Ϊ����1��HCN��B����2�����ԣ�CH3COOH��NH3H2O�ĵ���ƽ�ⳣ����ȣ�CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ��c(NH4+)=c(CH3COO-)��c(H+)=c(OH-)����3��c(Na+)��c(CN-)��c(OH-)��c(H+)����4��0.26
��1������ƽ�ⳣ�������ڱ�ʾ�������Ե�ǿ����ƽ�ⳣ��ֵԽС������Խ������ϵ���ƽ���ƶ�����
��2���ɱ������ݿ�֪��CH3COOH��NH3��H2O�ĵ��볣����ͬ�������Ӧ���ӵ�ˮ��̶�Ҳ��ͬ��
��3�������Һ��pH��7��˵����Һ�Լ��ԣ���CN-��ˮ��̶ȴ���HCN�ĵ���̶ȣ��ݴ˽�ϵ��롢ˮ��ķ���ʽ���з�����
��4�����BaSO4��BaCO3���ܶȻ����м��㡣