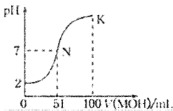
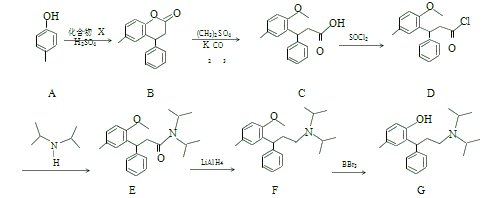
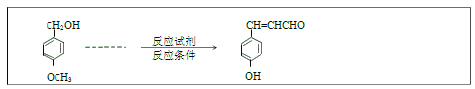
题目内容
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe +H2SO4 = FeSO4 +H2↑
FeSO4 + H2C2O4 + 2H2O =FeC2O4·2H2O↓+ H2SO4
2FeC2O4·2H2O + H2O2 + H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
回答下列问题:
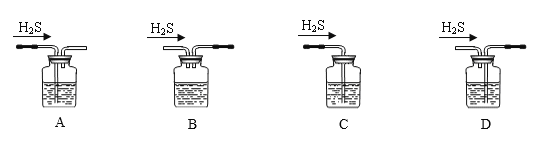
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是________(选填序号);
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是________;
(3)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入_____溶剂(填编号)
a. 冰水 b. 无水乙醇 c. 四氯化碳
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④步,⑥计算。
步骤⑤也被称做________操作,其目的是____________________________;
(5)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量________(填“偏高”、“偏低”或“无影响”);
(6)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,2.810g的晶体经操作最终获得了2.480g无水物,则此次测定的相对误差为____________。
【答案】A 防止H2O2分解 b 恒重 确保晶体已全部失去结晶水 偏低 -0.8%
【解析】
(1)气体吸收装置中既要吸收气体又能排出不反应的气体;
(2)温度高时,双氧水易水解;
(3)K3[Fe(C2O4)3]3H2O易溶于水,难溶于乙醇,根据相似相溶原理分析;
(4)晶体中所含结晶水可通过重量分析法测定,步骤⑤的目的是检验晶体中的结晶水是否已全部失去,也叫恒重操作;
(5)步骤③未在干燥器中进行,晶体中结晶水不能全部失去,据此判断;
(6)根据K3[Fe(C2O4)3]3H2O可计算出最终得到的无水物的质量,根据相对误差=![]() 计算。
计算。
(1)A.该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,A项正确;
B. 硫化氢与氢氧化钠接触面积较小,所以吸收不完全,B项错误;
C. 没有排气装置,导致该装置内气压增大而产生安全事故,C项错误;
D. 该装置中应遵循长进短出的原理,D项错误;
故答案为A;
(2)双氧水不稳定,温度高时,双氧水易分解,为防止双氧水分解,温度应低些;
(3)根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,所以得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入无水乙醇溶剂,故答案为b;
(4)晶体中所含结晶水可通过重量分析法测定,步骤⑤的目的是确保晶体中的结晶水已全部失去,也叫恒重操作;
(5)步骤③未在干燥器中进行,晶体中结晶水不能全部失去,所以称量出的水的质量偏小,测得的晶体中所含结晶水含量也偏低;
(6)根据K3[Fe(C2O4)3]3H2O可计算出最终得到的无水物的质量为=![]() =2.500g,所以绝对误差=2.480g2.500g=0.020g,相对误差为
=2.500g,所以绝对误差=2.480g2.500g=0.020g,相对误差为![]() = 0.8%。
= 0.8%。