题目内容
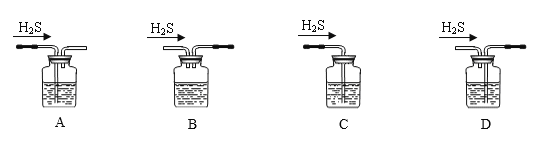
【题目】某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。
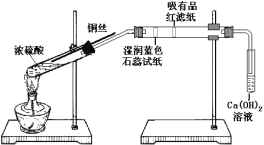
按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是( )
A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现出了二氧化硫的酸性、漂白性和弱氧化性
【答案】C
【解析】
A. 二氧化硫是酸性气体,二氧化硫和水反应生成亚硫酸,能使石蕊变红,二氧化硫具有漂白性,只能漂白部分有色物质,不能使石蕊褪色,A项错误;
B. 浓硫酸具有吸水性,把反应生成的水吸收,不是脱水,B项错误;
C. 铜与浓硫酸反应需要加热,停止加热,反应仍继续进行,说明该反应为放热反应,C项正确;
D. 二氧化硫是酸性气体,能使蓝色石蕊试纸变为红色,二氧化硫具有漂白性,可使吸有品红的滤纸褪色,二氧化硫和氢氧化钙反应也是酸性的表现,在此实验中,没有体现二氧化硫的弱氧化性,D项错误;
答案选C。

练习册系列答案
相关题目