题目内容
20.碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用.Ⅰ.人体碘的重要来源之一是食用加碘食盐(含KIO3).为检测食盐中的KIO3,并测定加碘食盐样品的碘含量,某实验小组设计了如下实验:
①用天平准确称取w g食盐样品,加适量蒸馏水使其完全溶解.
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全生成I2.
③以淀粉为指示剂,逐滴加入浓度为2.0×10-3mol•L-1的Na2S2O3溶液6.00mL,恰好反应完全.(已知:I2+2S2O32-═2I-+S4O62-)
(1)配平步骤②中反应的离子方程式:1 IO3-+5I-+6H+═3I2+3H2O
(2)步骤③中判断反应恰好完全的现象是溶液由蓝色变为无色.
(3)上述实验样品中碘元素的含量是$\frac{{254×{{10}^{-3}}}}{w}$mg/g(以含w的代数式表达).
Ⅱ.海带或海苔中含有丰富的碘元素,也是人体碘的一种来源.如图是实验室从海带(含I-)中提取碘单质的流程图.
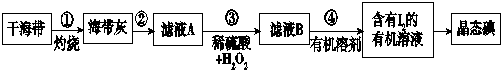
(1)步骤①中灼烧海带用到的实验仪器是a(填序号).
a.坩埚 b.试管 c.蒸发皿 d.烧杯
(2)步骤②的实验操作包括溶解和过滤.步骤④中分液所用的玻璃仪器是分液漏斗、烧杯.
(3)步骤③中反应的离子方程式是H2O2+2I-+2H+═I2+2H2O.
分析 Ⅰ.(1)该反应中I元素化合价由-1价、+5价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式;
(2)碘遇淀粉试液变蓝色;
(3)根据硫代硫酸根离子和碘酸根离子之间关系式计算;
Ⅱ.在坩埚中灼烧干海带得到海带灰,将海带灰用蒸馏水溶解,然后过滤得到滤液A,向滤液中加入稀硫酸和双氧水,双氧水在酸性条件下氧化碘离子生成碘,用有机溶剂萃取滤液B中碘,得到含有碘的有机溶液,最后蒸馏得到晶态碘;
结合题目分析解答.
解答 解:Ⅰ.(1)该反应中I元素化合价由-1价、+5价变为0价,转移电子数5,根据转移电子守恒、电荷守恒及原子守恒配平方程式为IO3-+5I-+6H+═3I2+3H2O,
故答案为:1;5;6;3;3;
(2)碘遇淀粉试液变蓝色,步骤③中判断反应恰好完全的现象是溶液由蓝色变为无色,故答案为:溶液由蓝色变为无色;
(3)根据IO3-+5I-+6H+═3I2+3H2O、I2+2S2O32-═2I-+S4O62-得关系式IO3----6S2O32-,
设碘酸根的物质的量为x,
IO3----6S2O32-,
1mol 6mol
x 2.0×10-3mol•L-1×0.006L,
x=$\frac{2.0×1{0}^{-3}mol/L×6×1{0}^{-3}L×1mol}{6mol}$=2.0×10-6mol,
根据碘原子守恒得n(I)=n(IO3-)=2.0×10-6mol,
则碘元素含量=$\frac{2.0×1{0}^{-6}mol×127g/mol}{wg}$=$\frac{{254×{{10}^{-3}}}}{w}$mg/g;
故答案为:$\frac{{254×{{10}^{-3}}}}{w}$;
Ⅱ.在坩埚中灼烧干海带得到海带灰,将海带灰用蒸馏水溶解,然后过滤得到滤液A,向滤液中加入稀硫酸和双氧水,双氧水在酸性条件下氧化碘离子生成碘,用有机溶剂萃取滤液B中碘,得到含有碘的有机溶液,最后蒸馏得到晶态碘;
(1)通过以上分析知,灼烧海带的仪器是坩埚,故选a;
(2)通过以上分析知,步骤②的实验操作包括溶解和过滤;分液所用玻璃仪器为烧杯和分液漏斗,故答案为:溶解和过滤;分液漏斗;
(3)酸性条件下,双氧水和碘离子发生氧化还原反应生成碘和水,离子方程式为H2O2+2I-+2H+═I2+2H2O,故答案为:H2O2+2I-+2H+═I2+2H2O.
点评 本题以碘与人体健康为载体考查海带中碘的检验、氧化还原反应等知识点,涉及实验基本操作、离子方程式的配平、离子方程式有关计算等知识点,侧重考查学生实验操作能力,题目难度不大.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 熔点:金刚石>金属钠>干冰 | B. | 离子半径:S2-<Cl-<K+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 热稳定性:CH4<NH3<H2O |
| A. | S2-的结构示意图 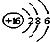 | B. | 中子数为16的硫原子:${\;}_{16}^{34}$S | ||
| C. | 羟基的电子式: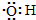 | D. | 乙烯的分子式:CH2=CH2 |
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 其中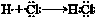 过程 过程吸收能量 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2CO3和K2O都属于盐 | B. | Na2O和Na2SiO3都属于氧化物 | ||
| C. | KOH和Na2CO3都属于碱 | D. | H2SO4和HNO3都属于酸 |
| A. | 氯化铝与足量的氢氧化钠溶液反应:Al3++4OH-═AlO2-+2H2O | |
| B. | 盐酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ |
| A. | 平均摩尔质量为31.8g/mol | B. | 质量仍为32g | ||
| C. | 密度仍与原气体密度相同 | D. | 对氢气的相对密度大 |
 ;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.