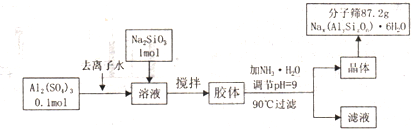
题目内容
17.实验室中可利用反应5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O来制取氯气.(1)用双线桥(或单线桥)标出下列反应中电子转移的方向和数目.5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O
(2)该反应中氧化剂是KClO3,氧化产物是Cl2.
(3)若有1mol KCl完全反应,则转移的电子的物质的量是1mol,制得标准状况下氯气的体积为13.44 L.
分析 (1)该反应中氯化钾中氯元素化合价由-1价变为0价,氯酸钾中氯元素的化合价由+5价变为0价,所以其转移电子数是5;
(2)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子的为还原剂,还原剂被氧化生成氧化产物;
(3)根据氯气和转移电子之间的关系式计算.
解答 解:(1)该反应中氯化钾中氯元素化合价由-1价变为0价,氯酸钾中氯元素的化合价由+5价变为0价,所以其转移电子数是5,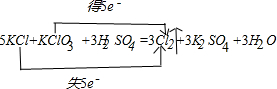 ,
,
故答案为: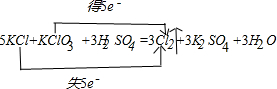 ;
;
(2)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,失电子的为还原剂,还原剂被氧化生成氧化产物,则Cl2为氧化产物
故答案为:KClO3;Cl2;
(3)若有1mol KCl完全反应,则转移的电子的物质的量是1mol,生成氯气为0.6mol,准状况下的体积为13.44L,故答案为:1;13.44.
点评 本题考查了氧化还原反应和双线桥法的应用,明确元素化合价是解本题关键,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.据报道:1994年11月9日德国科学家利用数亿镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天后,制得一种新原子269X(暂用X表示),它属于一种新元素--第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒.则该X元素原子核内的中子数是( )
| A. | 269 | B. | 110 | C. | 159 | D. | 82 |
8.下列化学用语正确的是( )
| A. | S2-的结构示意图 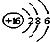 | B. | 中子数为16的硫原子:${\;}_{16}^{34}$S | ||
| C. | 羟基的电子式: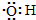 | D. | 乙烯的分子式:CH2=CH2 |
5.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | Na2CO3和K2O都属于盐 | B. | Na2O和Na2SiO3都属于氧化物 | ||
| C. | KOH和Na2CO3都属于碱 | D. | H2SO4和HNO3都属于酸 |
12.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝与足量的氢氧化钠溶液反应:Al3++4OH-═AlO2-+2H2O | |
| B. | 盐酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ |
9.在一容积为5L的密闭容器中放1mol 02放电产生下列反应:3O2═2O3,一段时间后,测得有20%的O2转化为O3,若温度和体积不变,对所得气体的下列说法不正确的是( )
| A. | 平均摩尔质量为31.8g/mol | B. | 质量仍为32g | ||
| C. | 密度仍与原气体密度相同 | D. | 对氢气的相对密度大 |