题目内容
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
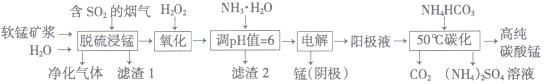
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
【答案】 MnO2+SO2=MnSO4(2分)或H2O+SO2 =H2SO3、MnO2+H2SO3=MnSO4+H2O Al (OH)3 l.0×l0-14mol/L 4OH--4e-=O2↑+2H2O Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O NH4HCO3与电解生成的酸反应,防止MnCO3沉淀溶解损失 NH4HCO3受热分解损失
MnCO3↓+CO2↑+H2O NH4HCO3与电解生成的酸反应,防止MnCO3沉淀溶解损失 NH4HCO3受热分解损失
【解析】(1)由流程可知,“脱硫浸锰”环节主要是二氧化硫与MnO2作用生成硫酸锰,化学方程式为MnO2+SO2=MnSO4或H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O。
(2)“脱硫浸锰”环节,铁、铝的氧化物等杂质也会反应,溶液中会有Al3+、Fe3+,可能还有Fe2+;氧化环节,加双氧水确保溶液中铁元素以Fe3+形式存在;加氨水调节溶液的PH=5~6把Al3+和Fe3+转化为沉淀除去,故“滤渣2”中主要成分的化学式为Fe(OH)3、Al(OH)3;常温下,pH=6时c(H+)=10-6mol/L,c(OH-)=Kw/c(H+)=10-8mol/L,此时溶液中的Fe3+物质的量浓度为: 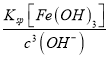 =
=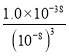 molL-1=l.0×l0-14mol/L。
molL-1=l.0×l0-14mol/L。
(3)“电解”时用惰性电极,阳极由水电离出的氢氧根离子放电,发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O(或2H2O-4e-=O2↑+4H+)。
(4)“50℃碳化”得到高纯碳酸锰,结合流程可得,Mn2+和HCO3-反应生成MnCO3和CO2,根据原子守恒,还有水生成,故离子方程式为Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O;因为①原溶液显酸性、②碳酸氢铵受热易分解,所以“50℃碳化”时加入过量NH4HCO3,可能的原因是:①NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;②可以防止NH4HCO3受热分解损失。
MnCO3↓+CO2↑+H2O;因为①原溶液显酸性、②碳酸氢铵受热易分解,所以“50℃碳化”时加入过量NH4HCO3,可能的原因是:①NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;②可以防止NH4HCO3受热分解损失。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A. 0.2mol/(Ls) B. 0.4mol/(Ls) C. 0.6mol/(Ls) D. 0.8mol/(Ls)