题目内容
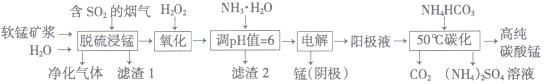
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
(1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有:
①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
【答案】 适当提高盐酸浓度或适当提高反应温度 2Fe2++Cl2=2Fe3++2Cl- Fe(OH)3 c 防止Cu2+转化为Cu(OH) 2沉淀
【解析】试题分析:本题以硅孔雀石为原料制备CuCl2的工艺流程为载体,考查流程的分析,外界条件对化学反应的影响,盐类水解知识应用于物质的分离,离子方程式的书写。
(1)为提高“酸浸”时铜元素的浸取率,可采取的措施有:适当加快搅拌速率,适当提高盐酸的浓度,适当提高反应的温度。
(2)硅孔雀石中加入盐酸“酸浸”时,发生的反应有:CuCO3·Cu(OH)2+4HCl=2CuCl2+CO2↑+3H2O、CuSiO3·2H2O+2HCl=CuCl2+H2SiO3+2H2O、FeCO3+2HCl=FeCl2+H2O+CO2↑、 Fe2O3+6HCl=2FeCl3+3H2O;经过滤得到滤渣1中主要成分为未反应的SiO2和生成的H2SiO3,滤液中主要含CuCl2、FeCl2、FeCl3,用氯气将FeCl2氧化成FeCl3,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-。
(3)根据流程图,加入试剂X调节pH的目的是将Fe3+完全转化为Fe(OH)3沉淀而除去,则“滤渣2”的主要成分为Fe(OH)3。Fe3+在水溶液中存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,能用于调节pH的试剂必须与H+反应且不引入新杂质。a项,Cu与H+不反应,不能调节pH,同时Cu会将FeCl3还原为FeCl2,错误;b项,NaOH能与H+反应,NaOH能调节pH,但引入杂质离子Na+,错误;c项,Cu(OH)2与H+反应生成Cu2+和H2O,c(H+)减小,促进Fe3+水解,能调节pH使Fe3+完全沉淀,且不引入新杂质,正确;d项,氨水能与H+反应,氨水能调节pH,但引入杂质离子NH4+,错误;答案选c。
Fe(OH)3+3H+,能用于调节pH的试剂必须与H+反应且不引入新杂质。a项,Cu与H+不反应,不能调节pH,同时Cu会将FeCl3还原为FeCl2,错误;b项,NaOH能与H+反应,NaOH能调节pH,但引入杂质离子Na+,错误;c项,Cu(OH)2与H+反应生成Cu2+和H2O,c(H+)减小,促进Fe3+水解,能调节pH使Fe3+完全沉淀,且不引入新杂质,正确;d项,氨水能与H+反应,氨水能调节pH,但引入杂质离子NH4+,错误;答案选c。
(4)“调pH”的目的是将Fe3+完全转化为Fe(OH)3沉淀而除去,而Cu2+仍留在溶液中,实现Cu2+和Fe3+的分离。“调pH”时,pH不能过高,防止Cu2+转化为Cu(OH)2沉淀。