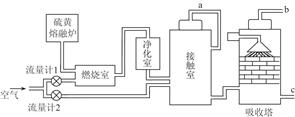
题目内容
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。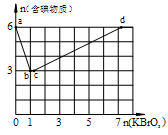
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化, 写出该反应的化学方程式 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
(1)I2;(2分)
(2)KBrO3+KBr+6H2SO4=3Br2+3H2O+3K2SO4(2分)
(3)KIO3和I2(2分)
(4)BrO3- > IO3- > Br2 > I2(2分)。
(5)溶液先无色,后变蓝色,合理给分(2分)
解析试题分析:(1)KBrO3溶液是强氧化剂,加入KI溶液,能够将碘离子氧化为I2;从含碘物质的物质的量的变化上也可以看出,一定是生成碘单质。
(2)b→c过程中,仅有一种元素发生化合价变化,我们从图上可以看出,含碘物质的物质的量并没有发生变化,那一定是别的物质的氧化还原反应了,在这个反应中,除了碘的化合价可以变化外, 也就只有溴元素了,因此反应为:KBrO3+KBr+6H2SO4=3Br2+3H2O+3K2SO4
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的物质的量小于6mol,也就是说并没有完全转变为负一价的溴,应该是混合物,化学式为KIO3和I2
(4)依据同一反应中,氧化剂氧化性大于氧化产物的氧化性可知:BrO3- > IO3- > Br2 > I2。
(5)溶液先无色,后变蓝色,
考点:考查氧化还原反应。