题目内容
【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。
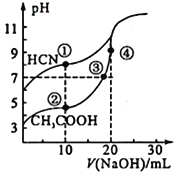
①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。
【答案】 CN-+H2O+H2O2=NH3↑+HCO3- ![]() 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C CN-+CO2+H2O=HCO3-+HCN > 1.4×10-3 NaCN HCN =
取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C CN-+CO2+H2O=HCO3-+HCN > 1.4×10-3 NaCN HCN =
【解析】(1)NaCN用双氧水处理后,产生一种酸式盐碳酸氢钠和一种能使湿润红色石蕊试纸变蓝的气体氨气,该反应的离子方程式是CN-+H2O+H2O2=NH3↑+HCO3-;(2)SCN-的电子式为![]() ;(3)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;(4)①HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+CO2+H2O=HCO3-+HCN;②根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,HCOONa >NaCN;(5)①常温时醋酸的电离常数Ka=
;(3)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;(4)①HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+CO2+H2O=HCO3-+HCN;②根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,HCOONa >NaCN;(5)①常温时醋酸的电离常数Ka=![]() =1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=
=1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=![]() =
=![]() mol·L-1=1.4×10-3 mol·L-1;②在①所示的溶液中是加入10mL氢氧化钠溶液,浓度与HCN相等但体积为其一半,则反应后溶质为NaCN和HCN;③点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)。
mol·L-1=1.4×10-3 mol·L-1;②在①所示的溶液中是加入10mL氢氧化钠溶液,浓度与HCN相等但体积为其一半,则反应后溶质为NaCN和HCN;③点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前4min的平均反应速率υ(Z)=0.0125 molL﹣1min﹣1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大