题目内容
【题目】为了探究外界条件对反应aX(g)+bY(g)cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.以下判断正确的是( ) 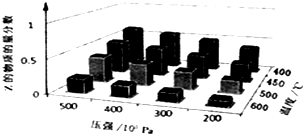
A.△H>0,a+b>c
B.△H>0,a+b<c
C.△H<0,a+b>c
D.△H<0,a+b<c
【答案】C
【解析】解:由图象可知,降低温度,Z的物质的量分数增大,说明降低温度平衡向正反应方向移动,所以正反应是放热的,则△H<0,
降低压强,Z的物质的量分数减小,说明压强减小,平衡向着逆反应方向移动,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有a+b>c,
故选C.
根据图象判断温度、压强的变化和Z的物质的量分数的变化趋势,再根据平衡移动原理中温度、压强对平衡移动的影响,可得出反应热以及反应前后化学计量数关系.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3;已知:NaSCN中S为-2价,写出SCN-的电子式___________。
(3)CN-中C元素显+2价,N元素显-3价,说明非金属性N>C,请设计实验证明:_____________。
(4)同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2,发生的离子反应为_______________________________。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONa______NaCN。(填“>”、“<”或“=”)
(5)常温下,用0.10mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。

①常温时醋酸的电离常数为1.96×10-5,0.10 mol·L-1CH3COOH溶液中c(H+)=__________mol·L-1。
②在①所示的溶液中溶质为_____
③在①和②所示溶液中c(CH3COO-)-c(CN-)_______(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。