题目内容
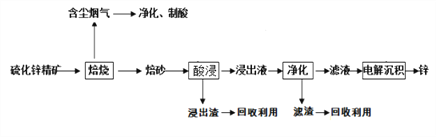
【题目】Ⅰ.重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeO·Cr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:

已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
请回答下列问题:
(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有________________(填化学式);
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是________(填字母代号);
a.溶液的颜色不变
b.v(CrO![]() )=2v(Cr2O
)=2v(Cr2O![]() )
)
c.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,常用还原沉淀法处理。该方法的工艺流程为:
,常用还原沉淀法处理。该方法的工艺流程为:
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
(4)请写出Cr2O![]() 与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
【答案】 NaAlO2和NaOH a 冷却结晶 Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
【解析】(1)氧化铝能与氢氧化钠反应生成偏铝酸钠,且反应中氢氧化钠过量,因此滤液1的溶质除Na2CrO4、Na2SiO3外,还含有NaAlO2和NaOH;(2)a.溶液的颜色不变说明浓度不再发生变化,反应达到平衡状态,a正确;b.v(CrO42-)=2v(Cr2O72-)不能说明正逆反应速率相等,不一定处于平衡状态,b错误;c.Cr2O72-和CrO42-的浓度相同不能说明正逆反应速率相等,不一定处于平衡状态,c错误,答案选a;(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是加热浓缩、冷却结晶、过滤、洗涤、干燥。(4) Cr2O72-具有强氧化性,与FeSO4溶液在酸性条件下反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】下表为元素周期表前三周期的一部分。
X | Z | ||
W | Y | R | |
(1)X的氢化物的沸点与W的氢化物比较,沸点较高的是:______________(填化学式),原因是_____________________。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式____________,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合____________。(填序号)。
A. 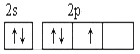 B.
B. 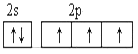
C.泡利原理 D.洪特规则
(3)以上W、Y、R元素原子失去核外第一个电子需要能量由多到少的顺序为:_______________(填元素符号)。