题目内容
【题目】下表为元素周期表前三周期的一部分。
X | Z | ||
W | Y | R | |
(1)X的氢化物的沸点与W的氢化物比较,沸点较高的是:______________(填化学式),原因是_____________________。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式____________,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合____________。(填序号)。
A. 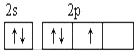 B.
B. 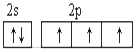
C.泡利原理 D.洪特规则
(3)以上W、Y、R元素原子失去核外第一个电子需要能量由多到少的顺序为:_______________(填元素符号)。
【答案】 NH3 NH3分子间易形成氢键 B D Ar>P>S
【解析】根据元素在周期表中的相对位置,首先判断出元素种类。然后结合问题逐一分析解答。
根据元素在周期表中的相对位置可判断X是N,Y是S,Z是F,W是P,R是Ar。
(1)NH3分子间易形成氢键,所以氨气的沸点高于PH3的沸点。(2)氮元素的核外电子排布式为1s22s22p3,则N的基态原子的最外层原子轨道表示式为B,答案选B。A中违反了洪特规则,答案选D。(3)稀有气体已经满足8电子稳定结构,P元素的3p轨道电子处于半充满状态,稳定性强,则P、S、Ar元素原子失去核外第一个电子需要能量由多到少的顺序为Ar>P>S。

【题目】金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K | Na | KCl | NaCl | |
熔点(℃) | 63.6 | 97.8 | 770 | 801 |
沸点(℃) | 774 | 882.9 | 1500 | 1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是( )
A.低于770℃
B.850℃
C.高于882.9℃
D.1413~1500℃