��Ŀ����
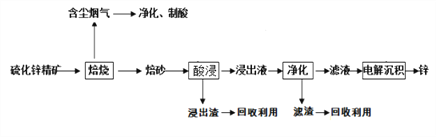
����Ŀ��п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�������Ҫ�ɷ���ZnS (����������FeS�������ɷ֣�������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ��
�ش��������⣺
��1����п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ___________������Һ���������м������Ҫ������п�ۣ���������___________��
��2�������������е������������壬�����������Ե缫�������ĵ缫��Ӧʽ��______________��
��3���ڸ������п�ѭ��ʹ�õ�������Zn��_________��
��4�����J��пұ������,�����ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʣ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ_________________��
��5����п����ZnS )��������ͭ��Һ��������ת��Ϊͭ����CuS��������÷�Ӧ������ԭ��____________________________��
��6���ҹ��Ŵ������á�������ұ��п��������Ӧ�����ġ��칤������й��ڡ�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�������Ȼ�������ú̿����ʢ�������н������ͺ죬���������������ȡ����������ǦҲ��������п������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________________________
(ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п����
���𰸡���ZnO ��ȥ Fe3+
��2H2O-4e-=O2��+4H+
��H2SO4
��2ZnS+4H++O2=2Zn2++2S��+2H2O
����һ�������£��ܽ��С�Ŀ������ת��Ϊ�ܽ�ȸ�С�Ŀ���
��ZnCO3+2C![]() Zn+3CO��
Zn+3CO��
����������п����ı��տ�����ZnO���������ȣ������������к���������������Ʊ����ᣬ����Һ�����������������п�����������������п��ַ�Ӧ�����û���������Һ����Ҫ��������п�������ɵõ�п�����ᣬ���Һ�к������ᣬ��ѭ�����ã��ݴ˷������
��1����п�����Ҫ�ɷ���ZnS�����������������������ԭ��Ӧ����ɰ����Ҫ�ɷ�ΪZnO������Һ�к��������ӣ���˾��������м���п�۵������dz�ȥ Fe3+����2�������������У��ǵ��ZnSO4������п���ӷŵ�����п������������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ2H2O-4e-=O2��+4H+����3�������������������ɣ���˿���ѭ�����õ����ʻ��������4������ѹ�����������˼�壬��֪��Ӧ���к���H+��O2�����Ի�÷ǽ�������S����Ӧ�Ļ�ѧ����ʽΪ��2ZnS+4H++O2=2Zn2++2S��+2H2O����5�����ݳ�����ת��ԭ����֪����һ�������£��ܽ��С�Ŀ������ת��Ϊ�ܽ�ȸ�С�Ŀ��������п����ZnS����������ͭ��Һ��������ת��Ϊͭ����CuS������6��������Ŀ������֪��Ӧ��ΪZnCO3��C�����ﺬ��Zn��CO����ѧ����ʽΪZnCO3+2C![]() Zn+3CO����
Zn+3CO����

����Ŀ�������غͽ����ƵĽ������������K��Na��ǿ�������ý�������KCl�����ƽ�����ʱ�����ּ����ƵĹ��������Է��룬������¶ȵ�һ���̶ȣ������������KCl��Ӧ��ȡK���������������ʵ��۷е㣺
K | Na | KCl | NaCl | |
�۵㣨�棩 | 63.6 | 97.8 | 770 | 801 |
�е㣨�棩 | 774 | 882.9 | 1500 | 1413 |
����ƽ���ƶ�ԭ��������֪��Na��KCl��Ӧ��ȡ�����ص������¶��ǣ� ��
A.����770��
B.850��
C.����882.9��
D.1413��1500��


