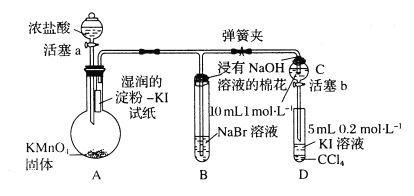
题目内容
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
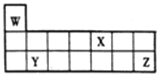
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
【答案】B
【解析】根据元素在周期表中的位置可知,W为H元素,X为N元素,Y为Mg元素,Z为Cl元素。A. 同周期从左到右,原子半径逐渐减小,同主族,从上到下,原子半径逐渐增大,原子半径:Y>Z>W,故A正确;B. Z的氧化物对应的水化物酸性不一定比X的强,如次氯酸为弱酸,硝酸为强酸,故B错误;C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键,如硝酸铵,故C正确;D. 镁是固体金属,氮气和氢气均为气体,氮气的相对分子质量大于氢气,因此单质的熔点:Y>X>W,故D正确;故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】已知 25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列有关说法正确的是
A. 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性
B. 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
C. NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-)
D. 1mol/L醋酸溶液加水稀释,所有离子浓度均减小