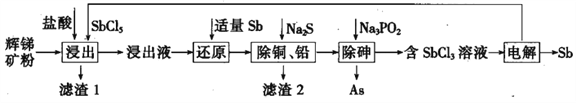
��Ŀ����
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ�������
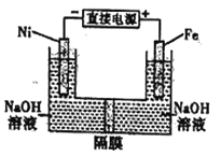
A. ����ĤΪ�����ӽ���Ĥ����OH-���������ƶ�
B. �����������缫��ӦΪFe-6e-+4H2O=FeO42-+8H+
C. ���ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ�pH����(������ǰ������仯���Բ���)
D. ���ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
���𰸡�C
�������������������ͼ��֪�������������缫��ӦʽΪFe��6e��+8OH���TFeO42��+4H2O��Ni�缫�������ӷŵ磬�缫��ӦʽΪ2H2O+2e���TH2��+2OH����A. �ɵ缫��Ӧ��֪����������OH������������OH��������ĤΪ�����ӽ���Ĥ����OH-���������ƶ���A����ȷ��B. �����������缫��ӦΪFe��6e��+8OH���TFeO42��+4H2O��B����ȷ��C. �ɵ缫��Ӧ��֪�����ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ���OH-Ũ�ȼ�С�ˣ�����pH������C��ȷ��D.���Ӳ�����Һ��ͨ������Һ�����������ӵĶ����ƶ�����ģ�D����ȷ������ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�