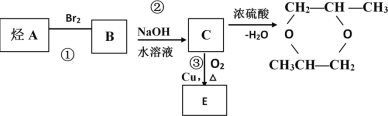
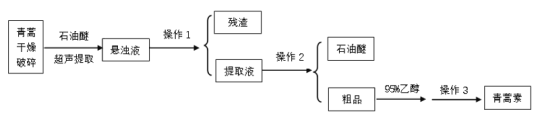
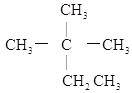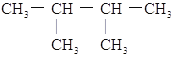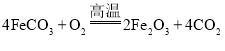题目内容
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论 |
A | 向黄色的 | 溶液变为紫红色 | 氧化性: |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中含有 |
C | 向 | 得到白色沉淀 | 相同温度下,溶度积常数: |
D | 一定温度下,向 | 溶液橙色变浅 | 减小 |
A.AB.B C.CD.D
【答案】D
【解析】
A.向![]() 溶液中滴加HI溶液,硝酸根和氢离子形成硝酸具有强氧化性,硝酸的氧化性强于三价铁离子,硝酸先氧化碘离子,故A错误;
溶液中滴加HI溶液,硝酸根和氢离子形成硝酸具有强氧化性,硝酸的氧化性强于三价铁离子,硝酸先氧化碘离子,故A错误;
B.向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液,品红溶液褪色,原溶液中含有![]() 、
、![]() 等,故B错误;
等,故B错误;
C. 未说明Mg2+和Cu2+共存的溶液中2种离子的浓度大小,无法判断溶度积常数的大小关系,故C错误;
D.加入KOH,减小![]() 浓度,
浓度,![]()
![]()
![]() 的平衡正向移动,溶液橙色变浅,故D正确;
的平衡正向移动,溶液橙色变浅,故D正确;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
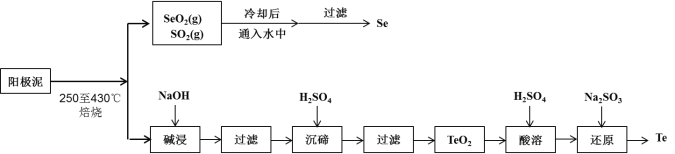
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)