题目内容
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
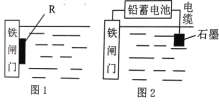
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
【答案】负极2Fe-4e-=2Fe2+ 正极O2+4e-+2H2O=4OH- B 负 0.1mol
【解析】
(1) 该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应;
(2) 原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
(3) 在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(4) 电解后溶液的 pH 为 13,即c(OH-)=0.1mol/L,溶液中n(OH-)=0.1mol,结合2Cl-+2H2O=Cl2↑+H2↑+2OH-计算转移电子的物质的量。
(1) 该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+2H2O+4e-=4OH-;
(2) 为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,但Na极易与水反应,则与铜和石墨都不能做电极材料,故答案为B;
(3) 电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极;
(4) 电解后溶液的 pH 为13,即c(OH-)=0.1mol/L,溶液中n(OH-)=0.1mol,由2Cl-+2H2O=Cl2↑+H2↑+2OH-可知,反应中生成的n(OH-)为0.1mol,则被氧化的Cl-的物质的量为0.1mol,故转移电子的物质的量为0.1mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案